Tag: anna fedorowicz endokrynolog
Lipoproteiny i apolipoproteiny
25 września, 2019 BlogLipoproteina (a)
Lipoproteina (a) należy do aterogennych lipoprotein. Składa się ona z: apolipoproteiny B- 100 (apo- B-100) oraz z dużej glikoproteiny apolipoproteiny (a) [apo(a)]. Apo (a) spotykana jest w kilku izoformach uzależnionych od skłonności genetycznych. Charakteryzuje się podobieństwem do plazminogenu, co sprawia, że blokuje jego receptory oraz wygasza proces fibrynolizy, czyli rozpuszczania zakrzepów.
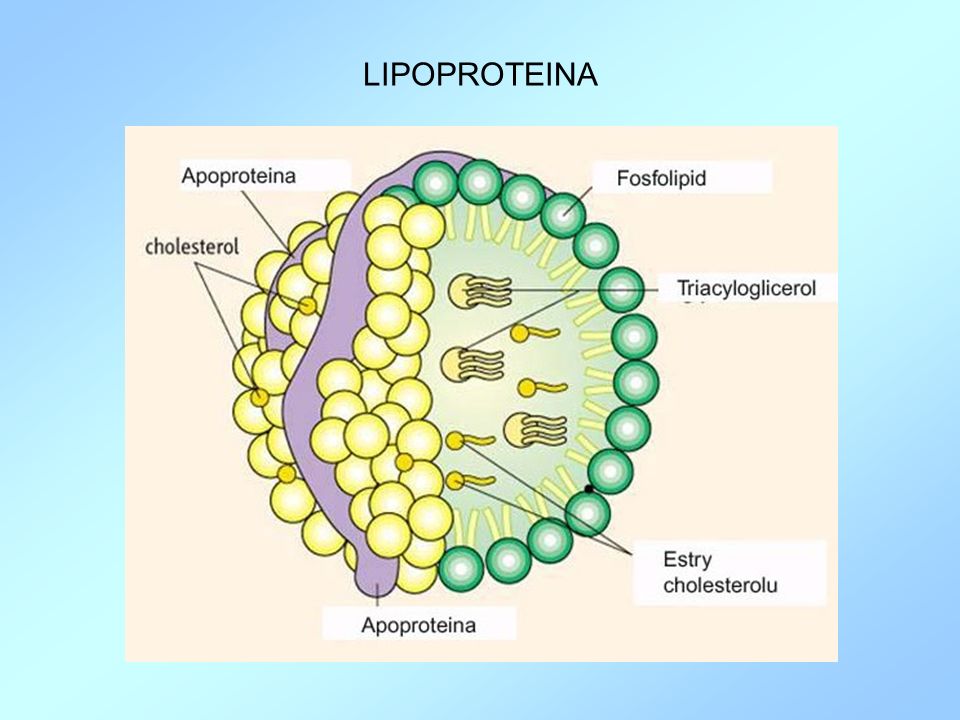
Struktura chemiczna lipoproteiny (a) jest zbliżona do złego cholesterolu (LDL) i ma silne działanie aterogenne. W jej skład wchodzą; apolipoproteina B, cholesterol i inne lipidy oraz specyficzne białko apolipoproteiny (a). Podwyższone stężenie lipoproteiny (a) powiększa niebezpieczeństwo zapadnięcia na choroby sercowo- naczyniowe oraz miażdżycę. Mimo uwarunkowań genetycznych, etiologia sposobu dziedziczenia nie została jeszcze odkryta. Rozmiar cząsteczki lipoproteiny jest taki sam u danej jednostki (osobnika), jednak są dostrzegalne odchylenia (różnice) pomiędzy poszczególnymi organizmami, co jest efektem odmiennej uwarunkowanej genetycznie liczby powtarzających się podjednostek nazywanych kringels. W ciągu dnia stan lipoproteiny (a) w surowicy krwi nie ulega dużym zmianom. Należy jednak zaznaczyć, że jest minimalnie niższe u mężczyzn i wzrasta u kobiet po okresie menopauzy. Badanie lipoproteiny (a) polega na pobraniu krwi do probówki i jest to zabieg inwazyjny.
U osób rodowodu afrykańskiego cząsteczki lipoproteiny (a) są większe.
Kiedy wykonujemy badanie lipoproteiny (a)
Badanie lipoproteiny (a) jest przydatne do określania czynników ryzyka chorób sercowo-naczyniowych. Wykonuje się je głównie u osób ze zwiększonym niebezpieczeństwem zapadnięcia na to schorzenie, obciążonych wywiadem rodzinnym. Oprócz rutynowych badań oznaczenia Lp(a) poddaje się również innym testom lipidowym. Oznaczenie stosuje się również u pacjentów, u których w rodzinie przytrafiała się przedwczesna choroba niedokrwienna serca. Badanie wykonuje się ponadto u osób skarżących się na schorzenia serca lub naczyń, zwłaszcza, gdy mamy do czynienia z prawidłowym lub nieznacznie podwyższonym stężeniem lipidów. Czasami badanie lipoproteiny (a) poleca się kobietom po okresie menopauzy, aby określić, czy wzrost Lp (a) związany jest ze spadkiem estrogenów, czy też jest czynnikiem zwiększającym ryzyko choroby niedokrwiennej serca.

Lipoproteina (a) badania
Norma: poniżej 150 mg/l.
Przebieg badania lipoproteiny: jednorazowe pobranie krwi z żyły łokciowej, skóra w miejscu pobrania powinna być odkażona. Pobranie krwi trwa od kilku do kilkunastu sekund.
Lipoproteina (a) należy do aterogennych lipoprotein. Składa się ona z: apolipoproteiny B- 100 (apo- B-100) oraz z dużej glikoproteiny apolipoproteiny (a) [apo(a)]. Apo (a) spotykana jest w kilku izoformach uzależnionych od skłonności genetycznych. Charakteryzuje się podobieństwem do plazminogenu, co sprawia, że blokuje jego receptory oraz wygasza proces fibrynolizy, czyli rozpuszczania zakrzepów.
Struktura chemiczna lipoproteiny (a) jest zbliżona do złego cholesterolu (LDL) i ma silne działanie aterogenne. W jej skład wchodzą; apolipoproteina B, cholesterol i inne lipidy oraz specyficzne białko apolipoproteiny (a). Podwyższone stężenie lipoproteiny (a) powiększa niebezpieczeństwo zapadnięcia na choroby sercowo- naczyniowe oraz miażdżycę. Mimo uwarunkowań genetycznych, etiologia sposobu dziedziczenia nie została jeszcze odkryta. Rozmiar cząsteczki lipoproteiny jest taki sam u danej jednostki (osobnika), jednak są dostrzegalne odchylenia (różnice) pomiędzy poszczególnymi organizmami, co jest efektem odmiennej uwarunkowanej genetycznie liczby powtarzających się podjednostek nazywanych kringels. W ciągu dnia stan lipoproteiny (a) w surowicy krwi nie ulega dużym zmianom. Należy jednak zaznaczyć, że jest minimalnie niższe u mężczyzn i wzrasta u kobiet po okresie menopauzy. Badanie lipoproteiny (a) polega na pobraniu krwi do probówki i jest to zabieg inwazyjny.
U osób rodowodu afrykańskiego cząsteczki lipoproteiny (a) są większe.
Kiedy wykonujemy badanie lipoproteiny (a)
Badanie lipoproteiny (a) jest przydatne do określania czynników ryzyka chorób sercowo-naczyniowych. Wykonuje się je głównie u osób ze zwiększonym niebezpieczeństwem zapadnięcia na to schorzenie, obciążonych wywiadem rodzinnym. Oprócz rutynowych badań oznaczenia Lp(a) poddaje się również innym testom lipidowym. Oznaczenie stosuje się również u pacjentów, u których w rodzinie przytrafiała się przedwczesna choroba niedokrwienna serca. Badanie wykonuje się ponadto u osób skarżących się na schorzenia serca lub naczyń, zwłaszcza, gdy mamy do czynienia z prawidłowym lub nieznacznie podwyższonym stężeniem lipidów. Czasami badanie lipoproteiny (a) poleca się kobietom po okresie menopauzy, aby określić, czy wzrost Lp (a) związany jest ze spadkiem estrogenów, czy też jest czynnikiem zwiększającym ryzyko choroby niedokrwiennej serca.
Lipoproteina (a) badania
Norma: poniżej 150 mg/l.
Przebieg badania lipoproteiny: jednorazowe pobranie krwi z żyły łokciowej, skóra w miejscu pobrania powinna być odkażona. Pobranie krwi trwa od kilku do kilkunastu sekund.
Materiał do badania lipoproteiny (a): surowica
Czas oczekiwania na wynik: jeden dzień
Lipoproteina (a) nie jet oznaczana klasycznie (rutynowo). Należy do podwyższonego ryzyka: miażdżycy, zakrzepicy, udaru mózgu oraz zawału mięśnia sercowego. Jej stężenie jest podwyższone u osób palących papierosy. Aby wynik był miarodajny należy odpowiednio przygotować się do badania.
Z uwagi na fakt, że poziom lipoproteiny (a) w organizmie jest uwarunkowany genetycznie, nie ulega zbyt dużym wahaniom przez całe życie. Nie reaguje również na leczenie i zmianę trybu życia. Z tej przyczyny lekarze czesto zalecają bardziej inwazyjne leczenie.
Kiedy nie należy wykonywać badania lipoproteiny?
Badania tego nie powinno się wykonywać w przypadkach:
– podczas gorączki
– po udarze
– w ciągu czterech tygodni po przebytym zawale serca
– w trakcie infekcji
– po spożyciu alkoholu
– po operacji
– u osób, które gwałtownie utraciły znaczną masę ciała
Wzrost stężenia lipoproteiny (a) może być spowodowany:
– niekontrolowaną cukrzycą
– hiperchoresterolemią rodzinną
– niedoczynnością tarczycy
– niedoborem estrogenów
– przewlekłą niewydolnością nerek
– zespołem nerczycowym
Niskie stężenie lipoproteiny (a) nie jest ryzykowną sytuacją, a wiele osób ma niewykrywalne stężenie Lp(a) we krwi.
Materiał do badania lipoproteiny (a): surowica
Czas oczekiwania na wynik: jeden dzień
Lipoproteina (a) nie jet oznaczana klasycznie (rutynowo). Należy do podwyższonego ryzyka: miażdżycy, zakrzepicy, udaru mózgu oraz zawału mięśnia sercowego. Jej stężenie jest podwyższone u osób palących papierosy. Aby wynik był miarodajny należy odpowiednio przygotować się do badania.
Z uwagi na fakt, że poziom lipoproteiny (a) w organizmie jest uwarunkowany genetycznie, nie ulega zbyt dużym wahaniom przez całe życie. Nie reaguje również na leczenie i zmianę trybu życia. Z tej przyczyny lekarze czesto zalecają bardziej inwazyjne leczenie.
Kiedy nie należy wykonywać badania lipoproteiny?
Badania tego nie powinno się wykonywać w przypadkach:
– podczas gorączki
– po udarze
– w ciągu czterech tygodni po przebytym zawale serca
– w trakcie infekcji
– po spożyciu alkoholu
– po operacji
– u osób, które gwałtownie utraciły znaczną masę ciała
Wzrost stężenia lipoproteiny (a) może być spowodowany:
– niekontrolowaną cukrzycą
– hiperchoresterolemią rodzinną
– niedoczynnością tarczycy
– niedoborem estrogenów
– przewlekłą niewydolnością nerek
– zespołem nerczycowym
Niskie stężenie lipoproteiny (a) nie jest ryzykowną sytuacją, a wiele osób ma niewykrywalne stężenie Lp(a) we krwi.
źródła zdjęć:
https://media.healthday.com/Images/icimages/doc_teen2262.jpg https://t3.ftcdn.net/jpg/00/76/6/02/500_F_76630210_YmRGB8uqy9rYcB8djgLMPzRt4KfpgcO4.jpg
https://slideplayer.pl/slide/10559857/33/images/8/LIPOPROTEINAm.jpg
Peptyd C i cukrzyca
29 sierpnia, 2019 BlogBadanie peptydu C jest przydatne w obserwacji wydzielania insuliny i stawianiu diagnozy powodów niskiego poziomu glukozy we krwi czyli hipoglikemii. Oznaczenie peptydu C może być pomocne w ustalaniu, kiedy należy wdrożyć leczenie insuliną.

Poziom peptydu C to jeden z podstawowych wskaźników, które są stosowane do wyróżniania rodzajów cukrzycy. Po wykryciu cukrzycy typu 1 peptyd C wydaje sąd o czynności komórek beta wysp trzustkowych. Jeśli chodzi o cukrzycę typu 2 badanie peptydu C jest wskazówką, która mówi nam, że niezbędne będzie rozpoczęcie podawania egzogennej formy insuliny. W odniesieniu do peptydu C stosuje się określenie oceny rezerw wydzielniczych trzustki. Powstaje w równomolowych ilościach z insuliną. Do jego oznaczenia używa się próbki krwi.
Czym jest peptyd C?
Peptyd C jest wytwarzany w efekcie rozpadu proinsuliny. Jest to substancja składająca się z aminokwasów. Rozszczepianie łańcucha proinsuliny i uwalnianie peptydu C zostało omówione po raz pierwszy w 1967 roku. Procesowi temu towarzyszy powstawanie insuliny. Z uwagi na fakt, że obie te substancje produkowane są w takiej samej ilości- peptyd C jest uważany za jeden z najlepszych parametrów do oceny produkowania insuliny. Nie jest degradowany w wątrobie tak jak to się dzieje w przypadku insuliny. Na skutek tego utrzymuje się we krwi znacznie dłużej- czas półtrwania peptydu C to około 30 minut a insuliny – 5 minut. Sprawia to, że w krwioobiegu znajduje się zazwyczaj 5 razy więcej peptydu C niż insuliny. Jest to korzystne ponieważ za pomocą tego można określić ile insuliny zostało uwolnionej do krwi i wyprodukowanej przez trzustkę.
Do czego służy peptyd C?
Peptyd C jest przydatny nie tylko do określenia ilości insuliny wytwarzanej przez organizm, czyli endogennej, ale także róznicuje ją od insuliny egzogennej, czyli podawanej w postaci leku. W drugiej sytuacji nie zostaje wytwarzany peptyd C. Ważnym jego zadaniem jest rola kliniczna , którą odgrywa w różnicowaniu typu 1 i typu 2 cukrzycy oraz cukrzycy typu LADA. Standardy te, to znaczy wykorzystanie oceny stężenia peptydu C w diagnostyce diabetologicznej ma miejsce od 1973 roku.

Peptyd C zmniejsza zmiany chorobowe, które są następstwem cukrzycy typu 1, należą do nich: hiperfiltracja kłębuszkowa, demielinizacja neutronów i stan zapalny śrudbłonka naczyń. Podwyższa funkcjonalne i strukturalne właściwości nerwów obwodowych. Stanowi barierę przed indukowaną przez hiperglikemię apoptozę i aktywuje proliferację komórek nerwowych.
Badanie peptydu C w jakim celu się je wykonuje?
Badanie peptydu c wykonuje sie przede wszystkim, aby obserwować produkcje insuliny przez komórki beta wysp trzustkowych. Pomiar ten jest przydatny w poznaniu przyczyny hipoglikemii czyli niedocukrzenia. Niski poziom glukozy we krwi może być spowodowany na przykład nadmierną suplementacją insuliny, spożywaniem alkoholu, czy chorobami wątroby lub nerek.
Badania peptydu C stosuje się w celu monitorowania efektywności leczenia wyspiaka czyli guza trzustki, który przyczynia się do niekontrolowanego produkowania insuliny i peptydu C. Peptyd C może być pomocny przy hierarchizowaniu pacjentów do przeszczepu komórek wysp trzustkowych i obserwacji skuteczności leczenia po przeszczepie. Oznaczenie peptydu c jest przydatne w ocenie zagrożenia pojawienia się zespołu metabolicznego, czyli komponowaniu się z: nadciśnieniem tętniczym, otyłością brzuszną, podwyższonym poziomem glukozy we krwi, insulinoopornością i dyslipidemią.
Badanie peptydu C zalecane jest osobom chorym na cukrzycę. Wykonuje się je aby uzgodnić, czy potrzebne będzie wdrożenie terapii insulinowej, a także w przypadku podejrzenia insulinooporności. Chorzy, którzy przechodzą terapię insulinową mogą wytwarzać przeciwciała przeciwinsulinowe, które zwyczajowo interferują z wynikami oznaczeń insuliny. Jest to przeszkodą w określeniu stopnia wytwarzania insuliny endogennej. Wówczas oznaczenie peptydu C okazuje się niezawodną opcją dla badania poziomu insuliny.
Na czym polega badanie peptydu C?
Pożywką do badania peptydu C jest próbka krwi z żyły łokciowej. Zazwyczaj należy nie spożywać posiłków przez 8-10 godzin przed jej pobraniem. W dniu poprzedzającym badania wskazane jest wyeliminowanie z diety obfitych, tłustych posiłków i unikanie spożycia alkoholu. Tuż przed testem można wypić niewielką ilość wody.
Pobranie próbki na czczo ma na celu oznaczenie wyjściowego poziomu peptydu C. Pogłębioną charakterystykę możemy uzyskać po badaniu próbki z podaniem dożylnie glukagonu. Po 6 minutach ponawia się pobieranie krwi na oznaczenie peptydu C. Czeka się na odebranie wyniku średnio 10 dni. Za badanie trzeba zapłacić około 45 złotych.
Peptyd C interpretacja wyników
Określenia wyników badania peptydu C powinien dokonać specjalista. Wysokie stężenie substancji pojawia się w warunkach: zwiększonej produkcji insuliny endogennej, wysokiego stężenia glukozy we krwi, zespołu Cushinga, niewydolności nerek, hipokaliemii i podczas ciąży. Wysokie stężenia peptydu C może informować o wznowieniu wyspiaka lub obecności przerzutów. Z kolei jego niskie stężenie wskazuje na niewystarczające wytwarzanie insuliny endogennej i skuteczność leczenia wyspiaka.
Przy diagnozowaniu cukrzycy podwyższone stężenie peptydu C oznacza występowanie cukrzycy typu 2, a niskie cukrzycy typu 1. Bolączką jest także niskie stężenie peptydu C w surowicy nie zwiększające się popodaniu glukagonu, może ono świadczyć o obecności cukrzycy typu LADA, która zalicza się do cukrzycy typu 1 o wolno postępującym autoimmunologicznym procesie niszczenia komórek beta, występuje u dorosłych.
Normy dla peptydu C
Fizjolologicznie stężenie peptydu C na czczo powinno wynosić 0,2–0,6 nmol/l (0,7–2,0 μg/l), a w 6. minucie po podaniu glukagonu – 1–4 nmol/l. Jeżeli stężenie peptydu C zalicza się do normy oznacza to, że trzustka posiada odpowiednie rezerwy insuliny.
źródła zdjęć:
https://adst.mp.pl/img/articles/przeglad_badan/istock000026801375640x475.jpg
https://www.diabetes.org.uk/resources-s3/migration/older-women-321×221.jpg
https://www.zdrowiewpraktyce.pl/appFiles/site_162/images/newsFeed/JVWRA2Ia0OwUQFp.jpg
Zwykłe zmęczenie czy astenia?
27 sierpnia, 2019 BlogCo to jest astenia?
Astenia to stan, w którym u pacjenta pojawiają się brak motywacji, przewlekłe zmęczenie, obniżenie samopoczucia. Do przyczyn tej choroby najczęściej należą: problemy związane z życiem rodzinnym lub pracą oraz niektóre przewlekłe choroby.

W klasyfikacji medycznej nazwa astenia wywodzi się z języka greckiego. Mianem tym określana jest choroba, której objawy dotykają sfery fizycznej, psychicznej i emocjonalnej. Nazwę astenia używa się również w odniesieniu do pewnego rodzaju budowy ciala.
Na czym polega astenia?
Astenia to przewlekły stan organizmu, który charakteryzuje się ogólnym spadkiem aktywności, a do subiektywnych objawów należą: odczuwanie przewlekłego zmęczenia, apatia, brak motywacji do działania. Zmiany te oprócz sfery intelektualnej i fizycznej dotykają również emocjonalności pozbawiając zdolności do przeżywania uczuć oraz ograniczają zdolność do nawiązywania relacji międzyludzkich.
Przyczyny astenii
Astenia jest stanem, którego źródła należy upatrywać w wielu zjawiskach. Przyczynę zaburzenia ogólnej mobilizacji i spadku wydolności fizycznej możemy łączyć z przewlekłą chorobą, której następstwem jest zmiana metabolizmu oraz przyrost ilości substancji szkodliwych w organizmie albo nadmierne zużycie jego zasobów energetycznych. Do takich schorzeń należą na przykład:
– niedoczynność tarczycy i inne zaburzenia hormonalne
– choroby metaboliczne na przykład cukrzyca i ich powikłania (na przykład ketoza w trakcie trwania hiperglikemii)
– choroby układu sercowo- naczyniowego lub oddechowego (niewydolność krążenia przewlekła duszność)
– zespoły wynikające z niewydolności nerek (mocznica)
– stany niedoborowe substancji odżywczych czy mikroelementów awitaminozy (spowodowane zespołami złego wchłaniania, anoreksją, wyniszczeniem w przebiegu choroby nowotworowej).
Do grupy przyczyn astenii zalicza się czynniki, które są związane ze środowiskiem życia. Należą do nich: hałas, zanieczyszczenia, przewlekła ekspozycja na gorąco, problemy rodzinne, wysoki poziom stresu w pracy, śmierć bliskiej osoby. Następstwem rozłożonej w czasie reakcji organizmu jest wyczerpanie zdolności do mobilizacji i skutkuje astenią.
Powodem astenii może być współczesne tempo życia. Pacjenci borykają się z koniecznością pracy pod ścisłą kontrolą z zawyżonymi normami wydajności. Wielkim utrapieniem staje się dla nich wielowątkowa praca, która nie pozwala na skoncentrowanie się na jednym problemie w korporacyjnym środowisku biurowym (maile, telekonferencje, komunikatory, media społecznościowe, telefony). Przyczynami wyczerpania i spadku mobilizacji są: pośpiech, zbyt duża liczba nadgodzin, czy długie dojazdy do miejsca pracy. Skutkują one tym, że po okresie pełnej mobilizacji i zwiększonej wydajności następuje stan wyczerpania i wypalenia.
Objawy astenii
Klasycznym objawem astenii jest ciągłe zmęczenie. Pacjent od przebudzenia się jest zmęczony, występuje u niego brak motywacji do podjęcia codziennych czynności. Ograniczone siły energetyczne organizmu oraz sprawność fizyczna, stanowią przeszkodę w wydajnym podejmowaniu kolejnych zadań (tak, w domu, jak w środowisku pracy). Zmianie ulegają również jego zdolności intelektualne, to znaczy zmniejsza się jego umiejętność kojerzenia faktów, przetwarzania informacji, odnajdywania rozwiązań. Co więcej człowiek staje się mniej odporny na stres- zdarza się często, że chory staje się nadmiernie nerwowy popada w histerię bądź otępienie. Unika wyzwań codziennego życia, takim jak stawianie czoła powszednim problemom. Wycofuje się także z sytuacji konfliktowych.

Przewlekłe zmęczenie i słaba kondycja psychiczna mogą prowadzić również do wtórnych objawów somatycznych, przypominających te nerwicowe to jest: bezsenność, kołatania serca, nudności i wymioty, zaburzenia żołądkowo- jelitowe. Spotyka się także wtórny objaw, którym jest znaczna utrata masy ciała. Chorego z astenią charakteryzuje znacznie zmniejszona zdolność do przeżywania emocji (zarówno smutku jak i radości). U chorego można zaobserwować apatię, może on być obojętny albo mieć spowolnione reakcje. Zdarza się, że rozwija się pełnoobjawowa depresja.
Asteniczna budowa ciała
Pojęcie to nie wiąże się z objawami klinicznymi, a jedynie oznacza charakterystyczną budowę ciała. Do jej cech charakterystycznych należą:
– mała masa mięśniowa
– wątła szczupła budowa ciała
– pochylona sylwetka z opuszczonymi ramionami, zapadnięta klatka piersiowa
Osoby takie mogą mieć zmniejszoną odporność na choroby, są słabsze psychicznie i fizycznie. Należy pamiętać, że tego typu budowa fizyczna nie jest jednoznaczna z tym, że ktoś choruje na astenię.
Leczenie astenii
Leczenie asteni jest trudne, z uwagi na fakt, że obejmuje ono też sferę emocjonalną. Trudno zachęcić chorego do pracy nad swoim zdrowiem. Zasadnicze znaczenie ma rozpoznanie pierwotnej przyczyny astenii, podjęcie leczenia choroby podstawowej i wykluczenie czynników stresogennych. W celu wyzwolenia u chorego chęci do zmiany i uwolnienia od negatywnego myślenia wdraża się leczenie farmakologiczne (na przykład poprawiające nastrój). Nieodzowna jest czasem psychoterapia, która pozwala zrozumieć mechanizm problemu (na przykład pracoholizm), uświadomić hierarchię wartości, czy ustalić nowe cele. Proces leczenia trwa długo i jest efektywny przy współpracy chorego z zespołem specjalistów.
źródła zdjęć:
https://www.misohinutricion.com/blog/wp-content/uploads/2017/0.jpg
https://www.hola.com/imagenes/estar-bien/2013040364142/astenia-primaveral-guia-basica/0-232-274/astenia–z.jpg
Objawy oczne w przebiegu chorób tarczycy
13 sierpnia, 2019 BlogChoroby gruczołu tarczycowego, a objawy oczne
Typowymi objawami chorób tarczycy są zmiany w okolicach powiek (oprócz oczywistych symptomów jakimi są osiowe objawy, które pojawiają się w przebiegu niedoczynności lub nadczynności tarczycy). Zmiany te wraz z towarzyszącymi im zniekształceniami okołogałkowymi należą do zespołu zmian oftalmopatii tarczycowej. Głównie widoczna jest retrakcja powiek z objawem Dalrympla (retrakcja powiek w usytuowaniu pierwotnym gałek ocznych), objawem Graefego (opóźnione opuszczanie się powieki górnej przy patrzeniu w dół) oraz symptomem Kochera czyli powszechnie rozpoznawalnym wytrzeszczem oczu i syndromem przestraszonych oczu. W leczeniu przestrzega się zasady terapii choroby podstawowej ponieważ w około 50% daje to pożądane efekty. Chirurgia powiek jest wykonywana dopiero na końcu terapii choroby oczu.
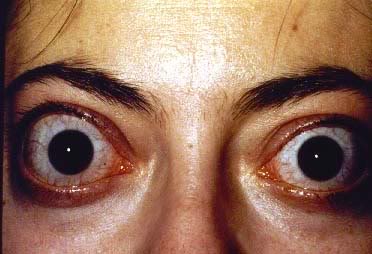
Znacznie częściej objawy oczne pojawiają się przy nadczynności tarczycy. Przy niedoczynności pacjentom doskwiera głównie zaburzenie ostrości wzroku, męczliwość wzroku i suchość gałki ocznej. Prezentacją choroby Gravesa-Basedowa i ciężkim jej powikłaniem jest natomiast wytrzeszcz złośliwy. Zmiany w miejscach gałki ocznej, zwłaszcza o zintensyfikowanym przebiegu klinicznym powodują niebezpieczeństwo utraty wzroku. Pochodzenie wytrzeszczu świadczy o zaburzeniach autoimmunologicznych. Czynnikami ryzyka jego wystąpienia jest na przykład palenie papierosów.
Objawy oczne w chorobie Gravesa- Basedowa
Choroba Gravesa- Basedowa należy do chorób autoimmunologicznych, u której źródeł leży genetyka. Kluczowa jest w tym schorzeniu nadczynność tarczycy, natomiast objawami towarzyszącymi są: powiększona tarczyca (tak zwane wole), wytrzeszcz gałek ocznych i obrzęk przedgoleniowy. Choroba ta jest najbardziej rozpowszechniona wśród osób w średnim wieku, szczególnie często występuje u kobiet (pięciokrotnie częściej).
Zmiany oczne występujące w tej chorobie towarzyszą innym objawom i w terminologii medycznej nazywa się je oftalmopatią naciekową- są one typowym objawem tej choroby. W okolicy powiek, tkanek, oczodołów i mięśniach poruszających gałką oczną powstają nacieki zapalne, złożone z limfocytów i masywny obrzęk. Nacieki znajdują się jeszcze za gałką oczną, czego następstwem jest wypchnięcie gałki ocznej poza granice kostne oczodołu i wytrzeszcz. W wyniku obrzęku ruchy powiek stają się wolniejsze przyczynia się to do zapalenia spojówek z współwystępującym światłowstrętem i łzawieniem. Fizjologicznym skutkiem zmian w mięśniach poruszających gałką oczną jest pojawienie się nieostrego lub podwójnego widzenia.
Charakterystyka objawów ocznych w chorobie Gravesa- Basedowa
– objaw Mobiusa – niedomoga konwergencji
– objaw Rosenbacha – drżenie powiek
– objaw Balleta – niedomoga mięśni zewnątrzgałkowych.
– objaw Stellwaga – brak częstego mrugania
– objaw Grova – opór na pociąganie w dół
– objaw Jelinka – nadmierna pigmentacja powiek,
– objaw Dalrympla – retrakcja powiek
– objaw Graefego – powieka górna nie nadąża za gałką oczną przy ruchu w dół
Diagnostyka choroby Gravesa- Basedowa
Aby dokonać badania osoby z wytrzeszczem należy najpierw zebrać dokładny wywiad chorobowy, wykonać badanie ostrości wzroku i widzenia barwnego, ocenę źrenic i ruchomości gałek ocznych, pomiar ciśnienia śródgałkowego, a także badanie palpacyjne oczodołu, tarczycy i węzłów chłonnych.
Leczenie choroby Gravesa- Basedowa
Choroba Gravesa – Basedowa podlega leczeniu. Można ją wyleczyć, a leczenie polega na: wdrożeniu środków farmakologicznych, interwencji chirurgicznej, bądź przy użyciu izotopów promieniotwórczych.
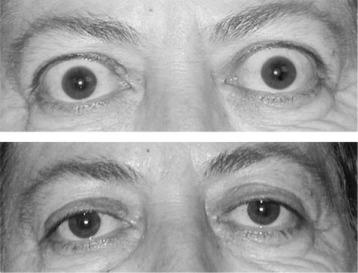
dół: oczy po udanym leczeniu
Pierwszym krokiem w leczeniu jest doprowadzenie do zahamowania czynności tarczycy. Aby wyleczyć zmiany oczne konieczne jest porozumienie endokrynologa i okulisty. Dla zauważenia zmian w obrębie oczodołu wykonuje się badanie ultrasonograficzne lub tomografię komputerową. Na leczenie składa się zażywanie hormonów sterydowych, a w razie, gdy wytrzeszcz oczu jest bardzo duży można polegać na rentgenoterapii lub zabiegu chirurgicznym. Za pomocą promieni rentgenowskich naświetla się odpowiednią dozą tkankę pozagałkową, natomiast leczenie chirurgiczne ma za zadanie powiększenie pojemności oczodołów przez usunięcie niektórych ścian kostnych.
źródła zdjęć:
http://2.bp.blogspot.com/_vT13IccOEqM/TQtX6KvNNOI/AAAAAAAAApw/J8nd279Srxo/s1600/Exophthalmos.jpg
https://image.slidesharecdn.com/tarczyca-zaburzenia-170605221401/95/tarczyca-zaburzenia-4-638.jpg?cb=1496700916.jpg
https://ars.els-cdn.com/content/image/1-s2.0-S001236921532482X-gr1.jpg
Zmiany hormonalne z wiekiem
1 sierpnia, 2019 BlogCharakterystyka hormonów i ich rola
Hormony mają za zadanie kontrolowanie prawidłowego przebiegu wielu ważnych procesów życiowych. Stabilizacja hormonalna jest konieczna do prawidłowego funkcjonowania organizmu. Zaburzenia hormonalne mogą mieć różne źródła i symptomy. Zdarza się, że istnieją wskazania do odwiedzenia endokrynologa i poddania się badaniu na poziom hormonów. Zabiegi te wykonujemy aby określić przyczynę zaburzeń hormonalnych i wdrożyć odpowiednie leczenie.
Hormony są produkowane przez gruczoły wydzielania wewnętrznego w organizmie:
– szyszynka
– tarczyca
– przysadka mózgowa
– podwzgórze
– grasica
– trzustka
– jądra
– przytarczyce
– nadnercza
– jajniki
To właśnie one grają rolę regulacyjną, pod ich wpływem zachodzą zmiany w wyglądzie fizycznym, masie ciała, oraz w stanach emocjonalnych.
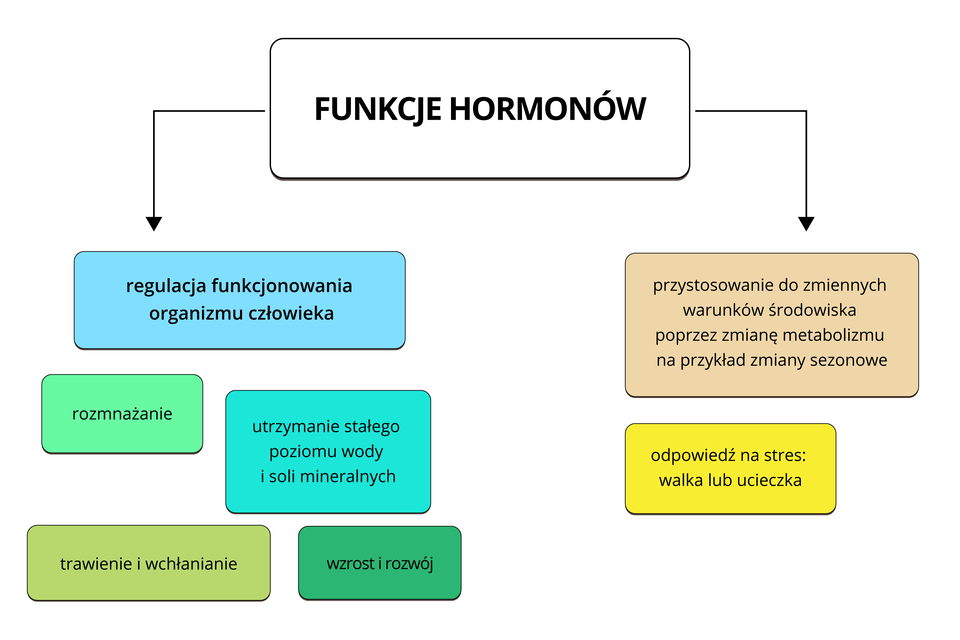
Hormony dostarczane są do organizmu za pośrednictwem krwi i docierają do wielu różnych narządów. Do ich funkcji należą pobudzanie i kontrolowanie pracy narządów oraz są one przyczyną zachodzących w nich zmian, do których należą: regulacja rytmu serca, metabolizmu, cykli miesiączkowych lub laktacji. Zaburzenia hormonalne łączą się z nadmiarem lub brakiem hormonów, z tego powodu wyróżnia się nadczynność lub niedoczynność.
Zaburzenia hormonalne charakterystyka
Gdy w organizmie dochodzi do zaburzeń hormonalnych bardzo często odbieramy różne znaki ze strony ciała. Niekiedy mamy do czynienia z zaburzeniami hormonalnymi wywołującymi: spadek libido, problemy skórne (na przykład trądzik, wysypkę, zmiany koloru i kształtu skóry, zwiększona jej twardość lub przyspieszone wystąpienie zmarszczek), nadmierne owłosienie.
Menopauza jako zaburzenie hormonalne
Menopauza (klimakterium) to okres w życiu kobiety, który charakteryzuje się miarowym przechodzeniem ze stanu płodnego w bezpłodny. Objawami współwystępującymi są: typowe uderzenia gorąca i zmiany nastroju.
U źródeł klimakterium leżą zaburzenia gospodarki hormonalnej, jest to proces naturalny, który nie powinien wzbudzać w nas lęku.
Należy zaznaczyć, że w fazie klimakterium ustaje menstruacja. Czego naturalną konsekwencją jest brak możliwości dalszego wydawania potomstwa. Znajduje się na przeciwnym biegunie menarche czyli pojawienia się u dziewcząt pierwszej miesiączki. Wystąpienie klimakterium najczęściej odnotowuje się między 45 a 55 rokiem życia. Najczęściej jednak obserwuje się jego rozwój w wieku 51 lat. Płodność ustępuje jednak już 10 lat przed menopauzą. Specjaliści najczęściej stawiają diagnozę menopauzy w okresie, kiedy zauważalny jest brak wystąpienia krwawienia waginalnego przez 12 miesięcy, wówczas kobieta nie produkuje już komórek jajowych. Stan ten możemy również określić jako wyraźny spadek produkcji hormonów przez jajniki.
U kobiet, u których usunięto macicę interwencją chirurgiczną, ale nadal mają one jajniki, klimakterium może być emblematem albo momentu pozbawienia narządu, albo faktycznego spadku produkcji hormonów. Kiedy mamy do czynienia z taką operacją charakterystyczne objawy menopauzy mogą wystąpić wcześniej niż przed ukończeniem 45 lat. Jeżeli okres zaniknie przed osiągnięciem wieku 40 lat, może to oznaczać poważne problemy zdrowotne za sprawą dysfunkcji układu autoimmunologicznego takiej jak choroba tarczycy albo cukrzyca. Według badań problemy natury ginekologicznej i związana z nimi przedwczesna menopauza mają również swoje korzenie w zespole przewlekłego zmęczenia- czyli naszym trybie życia.
Pierwsze symptomy menopauzy
Perimenopauza to czas kilku lat przed i po ustaniu wydzielania komórek jajowych. Do pierwszych symptomów zwiastujących zanikanie miesiączki należy brak ich występowania w regularnych odstępach czasu. Świadczy to o tym, że okres trwania miesiączki może się wydłużyć lub być wyraźnie krótszy, a jej obfitość mniejsza lub większa niż zazwyczaj. W tym czasie kobiety uskarżają się na charakterystyczne uderzenia gorąca, które trwają od kilkunastu sekund do minuty. Objawy te łączą się również z nadpotliwością, czerwienieniem się skóry (rumieniem), osteoporozą, zmniejszonym libido oraz drżeniem ciała. Symptomy te mogą trwać nawet do dwóch lat wraz ze współtowarzyszącymi zmianami nastrojów będącymi efektem zaburzonej gospodarki hormonalnej, oraz suchością pochwy i kłopotami ze snem. Po tym okresie w życiu kobiety, pojawia się czas zwany postmenopauzą, w którym jajniki w zupełności przestają produkować jajeczka.
Każda kobieta oczywiście subiektywnie odczuwa objawy towarzyszące klimakterium. Różna jest ich intensyfikacja i czas trwania pomiędzy różnymi kobietami. Według badań zarówno wiek występowania menopauzy jak i stopień jej nasilenia zależy w połowie od wskaźników genetycznych, a w połowie od uwarunkowań środowiskowych. Klimakterium trzeba łączyć przede wszystkim z wiekiem (bywa kojarzona ze wzrostem niebezpieczeństwa chorób serca), a nie z samą sytuacją utraty płodności. Stwierdzone jest, że niektórym kobietom, zapadającym na takie dolegliwości jak na przykład endometrioza, bądź bolesne miesiączkowanie przejście menopauzy zlikwiduje bądź osłabi przykre dolegliwości.
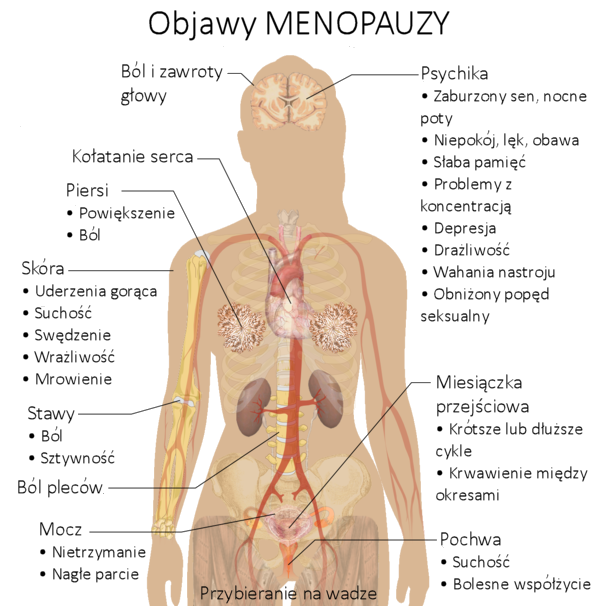
Typowe objawy menopauzy (klimakterium)
W trakcie trwania menopauzy kobiety cierpią najczęściej na takie dolegliwości jak:
– zaburzenia koncentracji
– depresja związana z wahaniami hormonalnymi, lękiem przed nową sytuacją
– bardzo wczesne pobudki związane z uczuciem niepokoju
– bóle głowy
– świąd pochwy
– ból podczas seksu (suchość pochwy i spadek estrogenów, które powodują zmniejszenie śluzu szyjkowego)
– nietrzymanie moczu (inkontynencja)
– zwiększona częstotliwość oddawania moczu
– kołatanie serca
– bóle mięśni
– trudności z zasypianiem i budzenie się w środku nocy
– uderzenia gorąca i pocenie się (najczęstszy objaw)
– przewlekłe zmęczenie
– rozdrażnienie
– nieuzasadniony niepokój i napady płaczu
Jeżeli zaobserwujesz u siebie takie objawy jak: plamienie między miesiączkami, po roku bez miesiączki ponowne krwawienie, coraz częstsze łamanie się kości niezwłocznie skonsultuj się z lekarzem.
Czy klimakterium należy się bać?
Przekwitanie to proces fizjologiczny, którego nie należy się bać, następuje wraz z wiekiem. Może ono jednak pojawić się przedwcześnie, u kobiet, które palą papierosy, przeszły chemioterapię oraz miały operacyjnie usunięte dwa jajniki. Klimakterium ma wielki wpływ na zmiany nastroju z uwagi na fakt zmniejszonego wytwarzania najważniejszych kobiecych hormonów – estrogenu i progesteronu. Występowanie klimakterium możemy uwiarygodnić badaniem diagnostycznym moczu lub krwi.
Klimakterium leczenie
Lekarze aby osłabić przykre objawy menopauzy często doradzają hormonalną terapię zastępczą. Terapia ta ma za zadanie wypełnienie niedoborów hormonów, które są wytwarzane naturalnie przez jajniki. Zastosowanie takiej terapii ma swoje korzyści takie jak: zapobieganie chorobie wieńcowej, miażdżycy, osteoporozie jednocześnie ma dodatni wpływ na układ moczowy, ośrodkowy układ nerwowy, skórę oraz śluzówkę. Leczenie niesie ze sobą pożądane efekty, jeżeli trwa minimum 5 lat. Niektórzy lekarze są jednak zdania, że prowadzenie terapii przez okres dłuższy niż 5 czy 7 lat, może skutkować zwiększonym ryzykiem raka piersi i raka endometrium.
W skład hormonalnej terapii zastępczej wchodzą dwa składniki: estrogen (tylko u pacjentek z usuniętą macicą) i progestagen. Terapia powinna być przeprowadzana pod kontrolą specjalistów: ginekologa, endokrynologa i internisty. Ponadto wyłączając wyżej wymienioną terapię, w celu wyleczenia objawów można wdrożyć naturalne hormony tak zwane fitoestrogeny. Należą one do estrogenów pochodzenia roślinnego, które w kompozycji z receptorami estrogenowymi mogą spełniać taką samą funkcję, jak te wydzielane przez organizm kobiety. Włączenie terapii fitoestrogenowej powinno być przeprowadzone już po 35 roku życia, po wcześniejszej konsultacji z lekarzem.
Sposobem na złagodzenie dolegliwości menopauzalnych może być rezygnacja z kofeiny i ubieranie się lekko lecz kilkuwarstwowo, może to uchronić przed koniecznością zażywania hormonów.
źródła zdjęć:
http://numer1.net/wp-content/uploads/2018/04/terapia-warszawa-par.jpg
https://static.epodreczniki.pl/portal/f/res-minimized/R1OUzvApCb7ZD/2/960/1lZkR189yRBFrHO6IEDNGxTKUOrVPjUb.jpg
https://bjmedical.pl/wp-content/uploads/2018/05/menopauza_objawy.png
Alkaloza metaboliczna
23 lipca, 2019 BlogCo to jest alkaloza metaboliczna?
Alkaloza metaboliczna zwana również zasadowicą metaboliczną lub nieoddechową należy do zaburzeń równowagi kwasowo- zasadowej. Równowaga ta to utrzymanie odpowiedniego stężenia jonów wodorowych w przestrzeni zewnątrz- i wewnątrzkomórkowej. Sprawia to, że komórki i narządy prawidłowo funkcjonują w organizmie. Wyznacznikiem, który wskazuje na stężenie jonów wodorowych jest pH krwi. Prawidłowo powinno ono wynosić około 7,35-7,45. Gdy pH jest większe od tej wartości mówi nam to o występowaniu zasadowicy (alkalozy), natomiast spadek pH świadczy o kwasicy.

Możemy rozdzielić kwasicę, jak i zasadowicę ze względu na mechanizm jej powstawania na oddechową i nieoddechową (metaboliczną). Zasadowica metaboliczna może zależeć od zwiększonej utraty jonów wodorowych, jak również od nadmiernego przyjmowania i zmniejszonego usuwania zasad, w tym jonów wodorowęglanowych.
Alkaloza metaboliczna – przyczyny
Do głównych przyczyn alkalozy metabolicznej należy utrata jonów wodorowych i chlorkowych z organizmu. Może się tak dziać na skutek wymiotów i biegunek drogą pokarmową, a także przez nerki na przykład w wyniku nadmiernego podania leków o działaniu moczopędnym.
Nie bez znaczenia jest hipowolemia czyli obniżenie objętości płynu zewnątrzkomórkowego. Efektem tego jest nadmierne wchłanianie jonów wodorowęglanowych w nerkach, a zatem rozwój zasadowicy.
Do utraty jonów wodoru przez nerki może dojść także w przypadku tak zwanej tubulopatii. W klasyfikacji medycznej należy ona do rzadkich chorób, które charakteryzują się zaburzeniem funkcji cewek nerkowych. Należą do nich między innymi zespół Barttera oraz zespół Gitelmana.
Alkaloza metaboliczna objawy
Objawy alkalozy metabolicznej są różne i mogą powodować obciążenie poszczególnych układów w różnym stopniu.
Jednym z wyróżników alkalozy metabolicznej są zaburzenia ze strony układu nerwowego. W związku z tym pacjenci mogą cierpieć na: zaburzenia świadomości, zaburzenia pamięci i koncentracji, psychozy, zaburzenia lękowe, zawroty głowy oraz parastezje.
Szczególnym zagrożeniem mogą być symptomy ze strony układu krążenia. Następstwem zaburzeń elektrolitowych mogą być zaburzenia rytmu serca. U chorych następują spadki ciśnienia tętniczego oraz spadek rzutu serca.
Skutkiem zaburzeń ze strony układu oddechowego jest niedobór tlenu we krwi czyli hipoksemia. Może się to wiązać z zaburzeniami pracy mięśni oddechowych.
Do innych objawów alkalozy należą: tężyczka czyli nadmierne skurcze mięśni spowodowane spadkiem poziomu wapnia w surowicy. Do skurczu szkieletowych mięśni kończyn mogą dołączyć tak zwane równoważniki tężyczki, które przybierają formę: skurczu naczyń mózgowych (następstwem tego jest przemijające niedokrwienie mózgu), skurczu naczyń wieńcowych (prowadzi to do objawów choroby niedokrwiennej serca), skurczu naczyń brzusznych (powoduje anginę brzuszną), a także skurczu naczyń obwodowych.
Alkaloza metaboliczna – powikłania i komplikacje
W przypadku nieleczenia możemy spotkać się z różnymi komplikacjami. Odmianę powikłania wyróżniamy na podstawie choroby prowadzącej do alkalozy. W przypadku współwystępowania ciężkich zaburzeń elektrolitowych możemy spotkać się z niebezpiecznymi dla życia zaburzeniami rytmu serca.

Hipowentylacja współistniejąca z zasadowicą metaboliczną może z kolei prowadzić do niedotlenienia ośrodkowego układu nerwowego. W trakcie trwania zasadowicy nieoddechowej pojawiają się działania kompensacyjne, których funkcją jest przywrócenie równowagi kwasowo- zasadowej. Towarzyszą temu procesowi płuca, które dzięki hipowentylacji zwiększają stężenie parcjalne dwutlenku węgla we krwi, oraz nerki, które pozbywają się nadmiaru wodorowęglanów.
Wartość pH krwi decyduje o rokowaniu. Wraz z jego wzrostem rokowanie pogarsza się. Przy wartości pH 7,65 śmiertelność osiąga około 80%.
Alkaloza metaboliczna- badania
Pierwszym badaniem, które wykonuje się w przypadku podejrzenia alkalozy metabolicznej jest gazometria krwi tętniczej. Badanie to polega na pobraniu krwi tętniczej – zazwyczaj z tętnicy udowej lub promieniowej. O alkalozie metabolicznej świadczy podwyższone pH – powyżej 7,45,oraz prawidłowe ciśnienie parcjalne dwutlenku węgla i zwiększony poziom wodorowęglanów. Jest to wówczas zasadowica metaboliczna niewyrównana. Efektem działania mechanizmów kompensacyjnych jest wzrost ciśnienia parcjalnego dwutlenku węgla, a w warunkach zasadowicy całkowicie wyrównanej do unormowania wartości pH.
Alkaloza metaboliczna – leczenie
W leczeniu alkalozy metabolicznej ważna jest walka z przyczynami leżącymi u źródła zachwiania równowagi kwasowo- zasadowej. Nieodzowne może się okazać odstawienie leków moczopędnych lub przeczyszczających. Pacjenci zmagający się z silnymi wymiotami i biegunkami powinni pamiętać o stosownym nawodnieniu- czyli płynoterapii. Kiedy stwierdzony zostaje niedobór potasu konieczne jest jego uzupełnienie.
Natomiast zaleca się aby osoby zdrowe trzymały się zasad prawidłowego żywienia, co może ustrzec je w przyszłości przed zachorowaniem na alkalozę metaboliczną.
źródła zdjęć:
https://szelazo.pl/wp-content/uploads/2018/10/zmęczenieanemia.jpg
https://img-3.fruugo.com/product/4/11/22127114_max.jpg
Rola glukagonu w organizmie
16 lipca, 2019 BlogCzym jest glukagon?
Glukagon należy do hormonów polipeptydowych produkowanych i wydzielanych przez komórki wysp trzustkowych. W przeciwieństwie do insuliny, podwyższa on stężenie cukru we krwi. Można go nazwać hormonem “głodu” ponieważ jego wydzielanie jest zwiększone, gdy mamy dłuższe przerwy między posiłkami, a poziom cukru zaczyna się obniżać do wartości około 70 mg/dl.
Rola glukagonu w organizmie
Glukagon odgrywa ważną rolę w organizmie bo od niego zależą procesy kataboliczne, to znaczy, kiedy on działa organizm czerpie źródło energii z naszych wewnętrznych zapasów, które są magazynowane w wątrobie i tkance tłuszczowej. Dlatego też glukagon możemy nazwać hormonem od spraw spalania tkanki tłuszczowej.
Mechanizm działania glukagonu
Mechanizm działania glukagonu jest bardzo łatwy. Organizm zawsze chce zachować stan równowagi. Gdy stężenie cukru po posiłku jest wyższe, do działania włącza się insulina, która magazynuje glukozę z krwioobiegu w komórkach. Glukagon zaś stanowi przeciwny biegun.
W sytuacji, gdy długo nie spożywamy posiłku, a stężenie cukru we krwi zaczyna spadać, jest to bodziec dla trzustki, aby zaczęła wydzielać glukagon, który trafiając do wątroby zaowocuje przetworzeniem zgromadzonego w niej glikogenu do glukozy. Drugim miejscem, na który wpływ wywiera glukagon jest tkanka tłuszczowa. To właśnie dzięki glukagonowi zaczynamy przekształcać zapasy tłuszczu do glukozy. W ten sposób pozbywamy się niechcianych kilogramów tłuszczu i za jego sprawą utrzymujemy stabilny poziom glukozy we krwi.
Dodatkową pobudką do wytwarzania glukagonu przez trzustkę jest zwiększone stężenie aminokwasów we krwi, które jest następstwem spożycia przez nas produktów będących źródłem białka.
Glukagon i insulina
Glukagon i insulina to zbiór hormonów w naszym organizmie, które działają na prawidłową gospodarkę węglowodanów i tłuszczów. Ich wspólną rolą jest utrzymanie stężenia cukru we krwi w pewnych bezpiecznych wartościach (65 – 100 mg/dl). Wówczas czujemy się dobrze i nie mamy symptomów hiper- lub hipoglikemii.
Problem zaczyna się wtedy, gdy jeden hormon zaczyna górować nad drugim. W dzisiejszej rzeczywistości najbardziej doskwiera nam nadmiar insuliny. W sytuacji, gdy stężenie insuliny utrzymuje się na wysokim poziomie, cały czas jesteśmy nastawieni na “budowanie i gromadzenie zapasów”. Dlatego też powinno się zwrócić uwagę na odpowiednio dobraną dietę, która pomaga w regulacji wydzielania obu hormonów i dojściu do równowagi.
Nadmiar glukagonu i jego skutki
Bardzo rzadko przypuszcza się, że norma glukagonu została przekroczona. Lekarz może zalecić jego oznaczenie w badaniu biochemicznym, gdy istnieje podejrzenie między innymi: cukrzycy, guza trzustki lub dwunastnicy, bądź niewytłumaczalny ubytek masy ciała. Normalnie w warunkach laboratoryjnych glukagon powinien wynosić 50 – 100 ng/l. Kiedy jesteśmy na diecie wysokobiałkowej możemy sprawić, że w organizmie będzie wyższe stężenie tego hormonu, dlatego też mogą być wyższe wyniki we krwi.
Niedobór glukagonu i jego skutki
Niedobór glukagonu jest bardziej powszechny niż jego nadmiar. Możemy powiedzieć, że niedobór ten jest pozorny ponieważ jego powodem jest niewłaściwa dieta (taka, która zawiera łatwo dostępne węglowodany, dużo cukru oraz, gdy często podjadamy). W ten sposób tworzymy spiralę częstych i dużych wyrzutów insuliny.
Jeżeli zastosujemy badania oznaczania insuliny i glukozy na czczo, możemy wstępnie rozpoznać, czy koło napędzania insulinowego może być naszym udziałem. Według statystyk norma insuliny na czczo u zdrowej osoby wynosi ok. 3-6 iIU/m. Niepokojąca dla nas powinna być wartość insuliny na czczo w okolicach 10 – 12 uIU/m. Świadczy to o tym, że organizm wytwarza zbyt duże ilości tego hormonu, a zatem nie ma warunków aby zadziałał w naszym ciele glukagon. Takie osoby często cierpią z tego powodu, że trudno im schudnąć. Czesto można zauważyć u nich proces przybierania na masie ciała, niejako z powietrza.
Glukagon a odchudzanie
Glukagon jest niezwykle ważnym hormonem w odchudzaniu i znacznie ułatwia ten proces. To właśnie za sprawą jego produkcji przez trzustkę pobudzona zostaje tkanka tłuszczowa do zmiany kwasów tłuszczowych na energię. W sytuacji, gdy w organizmie dominuje insulina, glukagon nie może przeforsować swego działania. Osobom, u których zanotowano nadmierny wzrost insuliny zaleca się odpowiednie zestawienie produktów w diecie, w oparciu o te o niskim indeksie glikemicznym, oraz ustalenie pory posiłków.

Najbardziej minimalizuje produkcję glukagonu częste podjadanie. Kiedy robimy sobie przerwę na przekąskę, co dwie godziny, cały czas doprowadzamy do wydzielania insuliny. Wówczas glukagon jest nieprzydatny ponieważ dostarczamy energię z zewnątrz z której otrzymujemy glukozę nie ma więc potrzeby spalania własnych zapasów.
Trzeba pamiętać, że każda przegryzka (każdy orzeszek gryz jabłka, kromka chleba zjedzona w pośpiechu) jest bodźcem do wydzielania insuliny. Nawet kawa z mlekiem, którą pijemy w ciągu dnia łyk po łyczku jest odbierana przez nasz organizm jako przekąska. Dobroczynne może się okazać wydłużenie okresów bez jedzenia do około 3,5- 4 godzin, wówczas może zacząć działać glukagon.
To, co może zaowocować szybszym wydzielaniem glukagonu w okresie poposiłkowym to zawartość białka w spożywanym posiłku. A zatem posiłki, które bazują tylko na węglowodanach są mniej sprzyjające organizmowi.
Oto składniki, które powinny być obecne w diecie: warzywa, w postaci surowej i gotowanej, pełnoziarniste zboża (chleb razowy, gruba kasza na przykład pęczak), produkt będący dobrym źródłem białka (jajka, mięso, rośliny strączkowe, ryby, twaróg, jogurt naturalny), oraz dodatek tłuszczu (oliwa z oliwek, olej rzepakowy, orzechy, niewielki dodatek masła).
Owoce powinny znajdować się w diecie jednak w mniejszych ilościach niż warzywa. Optymalna dawka warzyw do owoców to 4:1. Owoce można z powodzeniem łączyć w posiłku z produktem białkowym (na przykład jogurt) i niewielkim dodatkiem tłuszczu (na przykład orzechy). Efektem tego będzie to, że unikniemy nagłego dużego skoku insuliny i spowodujemy szybsze wydzielanie glukagonu.
źródła zdjęć:
https://apteline-cms.azureedge.net/cdntypo3/_processed1_/e/c/csm_glukagon-model-struktura-molekularna-fotolia-m_e94414c28c.jpg
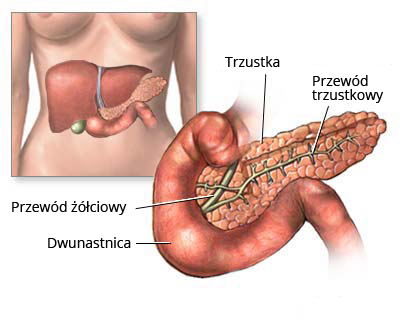
http://onkologia.org.pl/wp-content/uploads/trzustka.jpg
https://apteline-cms.azureedge.net/cdntypo3/_processed1_/f/a/csm_Monika_Frank_Dietetyk_4_ee9b2dc061.jpg
Guzki tarczycy
21 marca, 2019 BlogCo to są guzki tarczycy?
Tarczyca jest usytuowana w okolicy szyi. Tarczyca odpowiada za metabolizm. Guzki tarczycy można zdiagnozować poddając się badaniu USG tarczycy. Schorzenie to częściej występuje u kobiet niż u mężczyzn. Guzki tarczycy nie zawsze świadczą o nowotworze złośliwym tarczycy. Trzeba je jednak badać i kontrolować u lekarza. Ważne jest również aby obserwować guzki tarczycy.
Wykrywanie guzków tarczycy
Guzki tarczycy mogą być trudne do wykrycia, ponieważ początkowe objawy nie muszą świadczyć o chorobie. Pierwszym symptomem mogą być zawroty głowy, które jednak mogą towarzyszyć także innym chorobom. Czasami mogą wystąpić u chorego takie objawy jak bóle w okolicy klatki piersiowej lub też zaburzenia rytmu serca. W takiej sytuacji należy udać się do specjalisty, który po specjalnym badaniu orzeknie czy u pacjenta występują guzki tarczycy. Chory może się również uskarżać na uczucie dławienia w przełyku. O objawach tych należy niezwłocznie poinformować lekarza. Jest to ważne ponieważ badanie USG może wykryć nawet niewielkie guzki.
Guzki tarczycy – przyczyny
Niedobór jodu jest głównym powodem zachodzenia reakcji, których skutkiem jest powiększanie się tarczycy i powstawania jej guzków. Najbardziej narażone na chorobę, są osoby, które żyją w rejonach z niedoborem jodu. Jeżeli guzki tarczycy są wywołane na skutek tych braków, to może dojść do raka pęcherzykowatego. Nadmiar jodu też jest szkodliwy, mówimy wówczas o raku brodawkowym.
Guzki tarczycy mogą być również następstwem napromieniowania (na przykład podczas wybuchu nuklearnego), co z kolei skutkuje pojawieniem się nowotworu. Czynnikiem ryzyka jest też występowanie promieni jonizujących. Innym powodem, który przyczynia się do występowania guzków tarczycy jest czynnik genetyczny, choroba może być dziedziczona po rodzicach.
Guzki tarczycy – rodzaje
Guzki tarczycy mogą się pojawiać w postaci tzw. wola lub osobno. Jeśli guzki mają kształt o średnicy mniejszej niż 1 centymetr, wtedy istnieje prawdopodobieństwo, że nowotwór nie jest złośliwy. Zalecane jest także zbadanie stężenia TSH, czyli hormonu tyreotropowego, który powoduje, że gruczoł tarczowy wytwarza tyroksynę a także trójjodotyroninę. Gdy jest ono prawidłowe nie należy stosować leczenia.
Badanie powinno się powtarzać przynajmniej raz na 12 miesięcy, a także obserwować pacjenta. Gdy jednak guzki osiągają rozmiar o średnicy większej niż 1 centymetr, wtedy należy zbadać, czy zmiany nie są nowotworem.
Guzki, które mają postać wola inaczej nazywane są mnogimi. W zależności od tego ile hormonu wytwarzają, nie muszą być niebezpieczne (jeśli wytwarzają odpowiednią ilość hormonów są niegroźne). U pacjentów zdarza się również nadczynność tarczycy, w takim przypadku guzki tarczycy, czyli wole określa się jako toksyczne.

Guzki tarczycy – leczenie
Guzki leczyć można jodem promieniotwórczym lub też można zastosować zastrzyki etanolem. Guzki tarczycy mnogie zwalcza się operacyjnie szczególnie, gdy noszą one znamiona złośliwości. W celu wyleczenia guzków stosuje się także leczenie radiojodowe. W wypadku, gdy guzki mnogie uciskają drogi oddechowe stosuje się terapię operacyjną.
źródła zdjęć:
- https://moffitt.org/media/6574/thyroid-nodule-and-cancer-update.jpg
- https://docplayer.pl/docs-images/40/8437607/images/page_5.jpg
- http://bi.gazeta.pl/im/c6/cc/15/z22856902Q,Choroby-tarczycy-nie-sa-tylko-problemem-kobiet–Ta.jpg
Leptynooporność - ciągły głód i nadwaga?
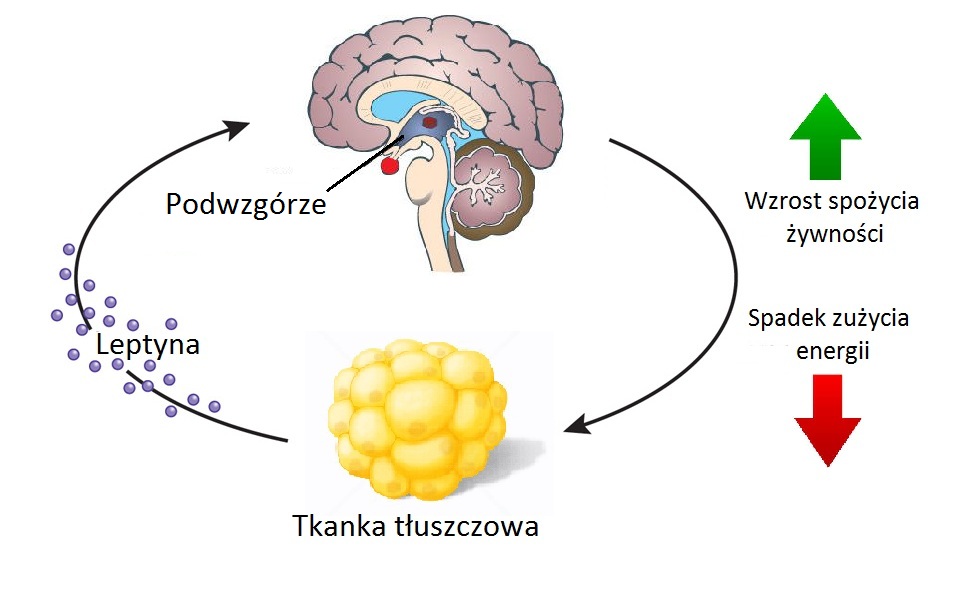
5 lutego, 2019 BlogCo to jest leptyna i leptynooporność:
Leptyna wiąże się z otyłością. Za przyczyną leptyny pojawia się uczucie sytości. U osób otyłych często jej działanie jest upośledzone- może się tak dziać ze względu na występowanie zjawiska leptynooporności. Jej skutkiem może być to, że duże ilości leptyny zamiast hamować apetyt będą go pobudzały. Leptyna to białko zawierające w swojej cząsteczce 146 aminokwasów. Gen, który ma za zadanie syntezę leptyny nazwany został Ob – “ob”od angielskiego obese oznaczającego otyłość i zajmuje on u człowieka miejsce na chromosomie 7.
Najbardziej znana jest zależność pomiędzy leptyną, normalizowaniem apetytu oraz zawartością tkanki tłuszczowej. Białko to oddziaływuje również na wiele innych układów organizmu, na przykład na układ odpornościowy, układ rozrodczy, czy kostno- stawowy. Dla organizmu niekorzystny jest zarówno niedobór jak i nadmiar leptyny.
Leptyna produkcja hormonu
Leptyna jest produkowana przede wszystkim w białej (podskórnej) tkance tłuszczowej. Ilość wyzwalania hormonu łączy się z bezpośrednio z tym jak dużo tłuszczu dany człowiek magazynuje w ciele. U osoby z bardzo rozbudowaną tkanką tłuszczową zauważyć można wysokie stężenie leptyny w organizmie, z kolei u osób szczupłych ze względu na posiadanie niewiele tkanki tłuszczowej stwierdzić można niewielką ilość krążącej leptyny. U kobiet częściej zauważa się wyższe stężenie leptyny we krwi, z uwagi na fakt, że u tej płci naturalnie występuje większe nagromadzenie tkanki tłuszczowej.
Pochodzenie leptyny wywodzi się głównie z tkanki tłuszczowej. Jednak także inne tkanki ciała mają zdolność do uwalniania tego hormonu. W zdecydowanie mniejszych ilościach leptyna może być produkowana w:
– żołądku
– szpiku kostnym
– brązowej tkance tłuszczowej
– jajnikach
– łożysku
– mięśniach szkieletowych
Leptyna: leptynooporność i jej związek z otyłością
Leptyna jest nazywana hormonem sytości. Jak wyżej nadmieniono ilość leptyny w organizmie jest związana z rozmiarem tkanki tłuszczowej( im więcej tkanki tłuszczowej, tym więcej leptyny w organizmie). Zważywszy na to można by postawić tezę, że osoby otyłe nie odczuwają głodu. Dzieje się jednak odwrotnie.

Leptynoopornością nazywamy położenie, w którym mózg “nie reaguje” na leptynę. Etiologia leptynooporności jest nie do końca poznana. Przypuszcza się, że następstwem krążenia w organizmie wyjątkowo znacznych ilości leptyny jest zmniejszenie się ilości receptorów dla leptyny lub uszczuplenie ich odczuwania tego hormonu. Apetyt pozostaje niezaspokojony, kiedy organizm nie odbiera znaków o sytości. Problem pociąga za sobą konsekwencje mechanizmu błędnego koła. Im człowiek więcej je tym wzrasta jego poziom tkanki tłuszczowej. Występują anomalia ponieważ leptyna, która w normalnych warunkach powinna hamować apetyt jest źródłem odkładania się tłuszczu.
W wyniku leptynoodporności wzrastające ilości hormonu sytości jedynie podtrzymują tą patologiczną sytuację. Leptynooporność może wystąpić wtórnie czyli w wyniku rozwinięcia się u pacjenta nadwagi czy otyłości. Takie przyczyny leptynooporności są najczęstsze. Problemy z leptyną mogą stanowić zaburzenie o postaci pierwotnej. Przyczyna otyłości może pochodzić od mutacji genu dla leptyny. U takich pacjentów występuje nieposkromiony apetyt, przez co cierpią oni z powodu otyłości, z którą mogą się łączyć insulinoporność oraz zaburzenia płodności.
Można to uznać za nietypowe ale leptyna może być antagonistą odchudzania. Jeśli pacjent jest na diecie to redukcja kilogramów może prowadzić jak już wyżej wspomniano do spadku leptyny. Mechanizm odczuwania głodu wiąże się natomiast z leptyną. Im mniej tego białka znajduje się w organizmie tym większy odczuwamy głód. Zmiany ilości leptyny związane z dietą mogą stać się przyczyną efektu jo-jo.

źródła zdjęć:
https://calkiemzdrowo.pl/wp-content/uploads/2017/05/leptynooporność_3.jpg
https://i.sadistic.pl/pics/ca7f2c5a8248.jpg
https://wspbm.edu.pl/wp-content/uploads/2018/06/dietetyka.jpg
Niewydolność hormonalna jąder
21 stycznia, 2019 BlogCzym jest niewydolność hormonalna jąder?
Niewydolność hormonalna jąder nazywana jest również hipogonadyzmem lub hipogonadyzmem męskim pierwotnym. Zaburzenia występujące w okresie dojrzewania lub dojrzałości są przyczyną tej choroby. Wśród zaburzeń tych znajdują się np. zaburzenia jąder, komórek Sertoliego lub Leydiga. Do najczęściej spotykanych objawów tej choroby należą: bezpłodność, zmiana głosu męskiego na bardziej kobiecy, czy ginekomastię.
W leczeniu niewydolności hormonalnej jąder choremu podaje się głównie hormony- testosteron, jednak czasem konieczne jest usunięcie jednego jądra. Hipogonadyzm występuje w dwóch postaciach pierwotnej i wtórnej.
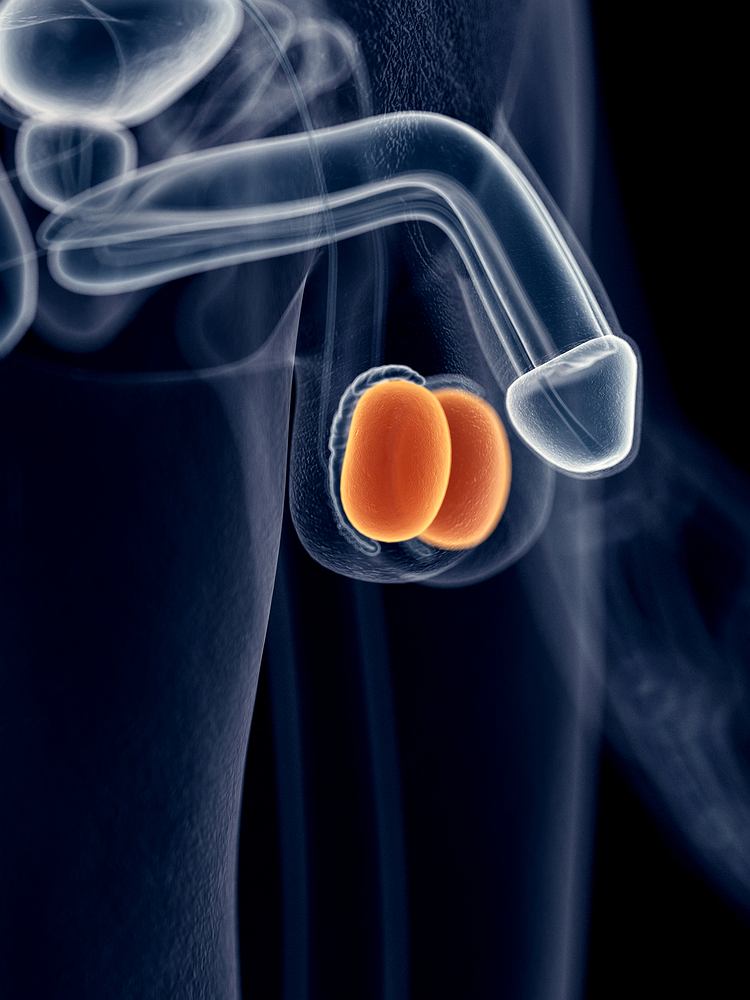
Jakie są rodzaje niewydolności hormonalnej jąder?
Niewydolność hormonalną jąder możemy podzielić na:
– całkowitą- wówczas równocześnie mamy do czynienia z niedoczynnością komórek Sertoliego oraz Leydiga (jest to spowodowane nadmiarem lutropiny i folitropiny)
– częściową- pojawia się zaburzona czynność hormonalna w komórkach Leydiga, następstwem tego jest nadmiar lutropiny lub brak czynności komórek Sertoliego
Przyczyny niewydolności hormonalnej jąder
Na niewydolność hormonalną jąder- przyczyniającą się m. in. do hipogonadyzmu- mogą wpływać różne czynniki takie jak:
– urazy mechaniczne
– promieniowanie Roentgena
– brak lub niedorozwój jąder (jądra)
– przewlekłe zatrucia (alkoholizm)
– choroby zakaźne ostre (rzeżączka, odra, ciągłe zapalenie przyusznic czyli świnka) i przewlekłe (kiła, gruźlica, cukrzyca)
– wiek (starzenie się)
– stany niedożywienia
– przepuklina pachwinowa
– wnętrostwo
– zaburzenie w chromosomach płciowych
– nowotwory
Nie ma ryzyka większych zaburzeń przy usunięciu lub uszkodzeniu jednego jądra w wypadku, gdy drugie jądro jest zdrowe. Zdrowe jądro przejmuje funkcje chorego.
Pierwotna niewydolność hormonalna jąder- jej przyczyny należy szukać w samych jądrach.
Wtórna niedoczynność hormonalna jąder- zachodzi gdy jądra zostają bezpośrednio uszkodzone na skutek zaburzeń w wydzielaniu hormonów (podwzgórza czy przysadki).
Eunuchoidyzm a niewydolność hormonalna jąder – różnice
Zespół objawów, który jest spowodowany niedorozwojem lub niedoczynnością jąder nazywany jest eunuchoidyzmem. Są uzależnione od wieku.
Możemy wówczas zauważyć:
– owłosienie i wygląd skóry typu kobiecego
– zmniejszenie siły mięśniowej
– niedorozwój narządów płciowych
– bezpłodność
– nadmiernie wysoki wzrost
– zanik mięśni
– zmęczenie
– brak wzwodu
– wysoki ton głosu
– zmniejszenie popędu płciowego
– brak mutacji
Nasilenie wymienionych objawów jest odpowiednio dostosowane do stopnia niedoczynności jąder. Kiedy jedno jądro jest zdrowe, to usunięcię drugiego nie ma wpływu na pojawienie się szczególnych zaburzeń w organiźmie.
Niewydolność hormonalna jąder – diagnoza i leczenie
Rozpoznanie choroby odbywa się na podstawie objawów, a także biorąc pod uwagę wyniki badań chorego. Po analizie wyników badań lekarz dokonuje diagnozy.
Do potrzebnych badań, które trzeba wykonać należą: badania hormonalne LH i FSH oraz badania prolaktyny, USG jąder i badania morfologiczne. Obejmują one (badania) sprawdzanie poziom hormonów męskich – androgenów (głównie testosteronu).

Jeśli chodzi o kwestię leczenia to pacjent powinien przyjmować preparaty z hormonami głównie z testosteronem przez odpowiednio długi czas. Leczenie takie określa się jako substytucyjne. Terapia odbywa się jedynie w specjalistycznych placówkach, biorąc pod uwagę całokształt stwierdzonych zmian – głównie laboratoryjnych badań hormonalnych.
źródła zdjęć:


