Miesiąc: lipiec 2019
Encefalopatia Wernickiego
30 lipca, 2019 BlogCo to jest zespół Wernickiego- Korsakowa?
Zespół Wernickiego to choroba o podłożu neurologicznym, której źródłem jest niedobór witaminy B1 czyli tiaminy. Kiedy jesteśmy zdrowi niedobór tiaminy jest bardzo rzadki. Najczęściej zespół Korsakowa spotyka się u osób przewlekle nadużywających alkohol. W tej chorobie możemy wyróżnić objawy neurologiczne i psychiatryczne. Głównie występują zaburzenia świadomości, rytmu dobowego, konfabulacje. Choroba ta zalicza się do zespołu objawów z grupy zaburzeń psychiatrycznych.
Zespół niedoboru witaminy B1
Witamina ta- tiamina należy do grupy witamin B. Tiamina występuje powszechnie w składzie wielu produktów roślinnych i zwierzęcych. Bogate są w nią głównie zboża (szczególnie bez wysokiej obróbki mechanicznej), rośliny strączkowe oraz mięso. Klasyczna dieta nie powoduje niedoboru tiaminy poniewż występuje ona powszechnie.

Do zmniejszenia jej stężenia w organizmie mogą doprowadzić schorzenia, które przebiegają z zaburzeniami wchłaniania. Wśród nich można wymienić:
– bulimię
– anorexię nervosę
– choroby żołądka
– raka żołądka
– zespół krótkiego jelita
Najpowszechniej jednak niedobór tej witaminy ma związek z nadużywaniem alkoholu.
Objawy zespołu Wernickiego
Występujący z pełnymi objawami zespół niedoboru witaminy B1 nazywany jest w terminologii medycznej zespołem Wernickiego – Korsakowa. Zespół ten składa się z objawów neurologicznych oraz psychiatrycznych. Trzeba pamiętać, że w zespole Wernickiego objawy psychiatryczne różnią się, tak przebiegiem jak i rodzajem, od tych które są obecne w zespole Korsakowa. Dodatkowymi skutkani ubocznymi niedoboru tiaminy są zaburzenia ze strony krążenia oraz zmiany skórne.
Zgodnie z nazwą zespół Wernickiego- Korsakowa sklada się z dwóch części – z zespołu Wernickiego i zespołu Korsakowa.
Klasycznie objawy w zespole Wernickiego pojawiają się w sposób gwałtowny. Często objawy mogą występować po wcześniejszym nadmiernym spożyciu cukrów. Statystycznie, kiedy nie jest objęty leczeniem nawet w 60% prowadzi do zgonu.
Objawy zespołu Wernickiego możemy sklasyfikować jako -objawy psychiatryczne oraz neurologiczne.
Do tych pierwszych możemy przypisać:
– zaburzony rytm dobowy- najbardziej typowe jest znaczne pobudzenie w godzinach nocnych
– zaburzenia świadomości pod postacią splątania, czasem prowadzące do śpiączki. Człowiek jest pozbawiony poczucia czasu, tego jak się nazywa, pory roku, nie umie określić, gdzie mieszka.
– obecny jest oczopląs (szybkie ruchy gałek ocznych w jednym kierunku) zaburzenie skojarzonego spojrzenia gałek ocznych oraz upośledzona reakcja źrenic na światło
– wśród zaburzeń neurologicznych głównie możemy wymienić zaburzenia gałkoruchowe oraz zaburzenia postawy nazywane ataksją tułowia, której przejawem jest niemożność utrzymania prawidłowej postawy ciała.
Z uwagi na fakt, że witamina B1 jest konieczna do prawidłowego funkcjonowania układu krążenia, jej niedobór w zespole Wernickiego może przyjmować postać takich objawów jak:
– przyspieszenie akcji serca
– obrzęki obwodowe
– niewydolność serca
Zaburzenie wynikające z układu krążenia może być przyczyną śmierci.
Objawy zespołu Korsakowa
Drugim elementem zespołu Wernickiego- Korsakowa jest zespół amnestyczny Korsakowa. Objawy w tym zespole wiążą się głównie z funkcjami psychicznymi człowieka. Najczęściej charakteryzują się przebiegiem przewlekłym i są trudniejsze do wyleczenia.
Naczelnym objawem w zespole Korsakowa są zaburzenia pamięci. Kiedy mówimy o zaburzeniach pamięci w tej chorobie, to mamy na myśli zaburzenia zarówno pamięci wstecznej jak i następczej. Jest to równoznaczne z tym, że u człowieka borykającego się z zespołem Korsakowa występuje niemożność przypominania sobie wydarzeń z przeszłości (zarówno tej dalekiej jak i bliskiej na przykład tego, co wydarzyło się wczoraj), oraz brak przyswajania sobie nowych informacji.
Dziury w pamięci zapełnia tak zwanymi konfabulacjami – czyli wymyślonymi wydarzeniami. Konfabulacji nie należy odbierać jako mówienia nieprawdy, czy celowego oszukiwania. Człowiek ten nie jest bowiem świadomy, że podaje fałszywe informacje. Jest przekonany, że wydarzenia, o których mówi miały miejsce.

Inną cechą zespołu Korsakowa są zaburzenia osobowości. Często spotykane są takie cechy jak: labilność emocjonalna, niedostosowanie zachowania do sytuacji, odhamowanie.
Leczenie zespołu Wernickiego- Korsakowa
Leczenie zespołu Wernickiego- Korsakowa na etapie ostrych dolegliwości zawsze kwalifikuje się do pobytu w szpitalu. Najpilniejsze jest uzupełnienie niedoboru witaminy B1. W związku z utrudnionym wchłanianiem, najczęściej witamina podawana jest w postaci zastrzyków domięśniowych. Powinno się również pamiętać o ograniczeniu w tym czasie podaży cukrów oraz o prawidłowym nawodnieniu. Kiedy ostre objawy zespołu niedoboru witaminy B1 ustąpią należy przewlekle ją uzupełniać suplementami oraz zachować całkowitą abstynencję. Niestety nie zawsze udaje się uzyskać całkowitą poprawę stanu zdrowia. Niektóre objawy psychiatryczne, szczególnie te, które zaliczają się do zespołu Korsakowa są nieuleczalne.
źródła zdjęć:
https://www.miod-malina.pl/zdjecia/witamina-b1.jpg
https://ocdn.eu/pulscms-transforms/1/MLIktkqTURBXy9jN2YxZWIzODEzNDI4NDgyOWU2OGM2NzIwYTI2MWU5MS5qcGVnk5U
D_3XNCEjNBKmTBc0DFM0BvJUH2TIvcHVsc2Ntcy9NREFfLzE0MGIxY2ZlN2YwYWM1MmVkYzAxMGQ3MDk3OGU4NGJlLnBuZwDCAA
Wpływ wapnia na zęby
25 lipca, 2019 BlogKażdy wie jak ważna jest funkcja wapnia w organizmie człowieka. Jest nie tylko pierwotnym budulcem kości, zębów i paznokci.Oprócz tego, że zapobiega osteoporozie, odpowiada również za prawidłową pracę serca oraz przewodzenie impulsów nerwowych. Wspiera działanie bardzo wielu ważnych enzymów, reguluje krzepliwość krwi, zwiększa przepuszczalność naczyń krwionośnych, a wreszcie – nadzoruje kurczenie i rozkurczanie mięśni i niweluje reakcje alergiczne.

Wapń powinien być codziennie dostarczany do organizmu ludzkiego, bo jest każdego dnia tracony na skutek różnych procesów fizjologicznych.
→ Niedobór wapnia ma poważne konsekwencje
Niedobór wapnia jest nazywany inaczej hipokalcemią i może być spowodowany wieloma bodźcami. Najczęstszym powodem niedoboru wapnia jest dieta uboga w produkty zawierające ten makroelement lub jego niska biodostępność (problemy z przyswajaniem). Jednakże hipokalcemia może się objawiać również w zaburzeniach gospodarki hormonalnej i niewydolności nerek, a także może występować przy niedoborze witaminy D i magnezu.
Kiedy niedobór wapnia nie jest duży jego symptomami mogą być: skurcze mięśni, uczucie drętwienia i mrowienia w rękach i nogach, bóle w stawach i zwolnienie tętna. W skrajnym niedoborze mogą występować krwotoki, zaburzenia snu, stany lękowe, złamania kości, a u dzieci- zaburzenia wzrostu. Niedobór wapnia wywołuje również osteoporozę.
→ Niedobór wapnia a problemy stomatologiczne
Niektórzy sądzą, że ponieważ wapń stanowi ważny budulec zębów oraz kości, to kiedy nam go zaczyna brakować, organizm radzi sobie z tą sytuacją czerpiąc ten pierwiastek nie tylko z tkanki kostnej ale także z uzębienia. Ten pogląd jest popularny wśród kobiet w ciąży, które większą wrażliwość swoich zębów na próchnicę tłumaczą przekonaniem, że dziecko “wyciąga”z ich organizmu wapń i witaminy. Warto jednak nadmienić, że taka opcja jest niemożliwa. O ile możemy dostrzec u kobiet ciężarnych niewielką utratę substancji mineralnych w kościach, to jednak uwapnienie zębów jest niezmienne. “Pobranie” z zębów wapnia jest niemożliwe z uwagi na fakt, że w zębach wapń jest związany pod postacią kryształów hydroksyapatytu.
Tymczasem naukowcy obserwują istnienie silnej zależności między zawartością wapnia w organizmie a chorobami przyzębia. Zdaniem naukowców z wapniem powiązane są tkanki przyzębia ponieważ bierze on udział w regulacji gęstości kości szczęki i wyrostka zębodołowego. Kiedy mamy braki wapnia w organizmie dochodzi do słabszego osadzenia zębów w kości szczęki, a co za tym idzie zwiększa się ryzyko paradontozy.
→ Zalecane dawki
Aby uniknąć niedoboru wapnia powinniśmy pomyśleć o jego codziennym uzupełnianiu. Zalecenia co do jego dziennego spożycia opracował Instytut Żywności i Żywienia. Zapotrzebowanie na ten pierwiastek jest zależne od płci i wieku. U dzieci między 2 a 8 rokiem życia dzienna podaż tego makropierwiastka powinna wynosić 1000 mg, między 9-17 rokiem życia 1600 mg, a między 18 a 30 rokiem życia – 1100 mg na dobę. U dorosłych kobiet wapń dostarczać trzeba w dawce 1200 mg, natomiast w okresie pomenopauzalnym większej bo 1500 mg.

Bogate w wapń jest zarówno mleko, jak i cała gama przetworów mlecznych (kefir, jogurt, maślanka, biały ser, zsiadłe mleko). Wapń możemy spotkać także w innych produktach spożywczych i to w wersji bogatszej od mleka.
Dostępne są także suplementy diety zawierające wapń oraz takie napoje. Powinniśmy więc codziennie dostarczać organizmowi odpowiednią dawkę wapnia, pomoże w tym zbilansowana dieta.
Nawet jeśli nie jesteśmy zwolennikami mleka lub jesteśmy na nie uczuleni to z powodzeniem możemy zastąpić je innymi pokarmami bogatymi w ten pierwiastek.
źródła zdjęć:
https://images.agoramedia.com/everydayhealth/gcms/photogallery_lactose_intolerance_foods_01_full.jpg?width=684 http://bi.gazeta.pl/im/74/7d/e2/z14843252Q,Niektore-zrodla-wapnia-w-pozywieniu-moga-zaskakiwa.jpg
Alkaloza metaboliczna
23 lipca, 2019 BlogCo to jest alkaloza metaboliczna?
Alkaloza metaboliczna zwana również zasadowicą metaboliczną lub nieoddechową należy do zaburzeń równowagi kwasowo- zasadowej. Równowaga ta to utrzymanie odpowiedniego stężenia jonów wodorowych w przestrzeni zewnątrz- i wewnątrzkomórkowej. Sprawia to, że komórki i narządy prawidłowo funkcjonują w organizmie. Wyznacznikiem, który wskazuje na stężenie jonów wodorowych jest pH krwi. Prawidłowo powinno ono wynosić około 7,35-7,45. Gdy pH jest większe od tej wartości mówi nam to o występowaniu zasadowicy (alkalozy), natomiast spadek pH świadczy o kwasicy.

Możemy rozdzielić kwasicę, jak i zasadowicę ze względu na mechanizm jej powstawania na oddechową i nieoddechową (metaboliczną). Zasadowica metaboliczna może zależeć od zwiększonej utraty jonów wodorowych, jak również od nadmiernego przyjmowania i zmniejszonego usuwania zasad, w tym jonów wodorowęglanowych.
Alkaloza metaboliczna – przyczyny
Do głównych przyczyn alkalozy metabolicznej należy utrata jonów wodorowych i chlorkowych z organizmu. Może się tak dziać na skutek wymiotów i biegunek drogą pokarmową, a także przez nerki na przykład w wyniku nadmiernego podania leków o działaniu moczopędnym.
Nie bez znaczenia jest hipowolemia czyli obniżenie objętości płynu zewnątrzkomórkowego. Efektem tego jest nadmierne wchłanianie jonów wodorowęglanowych w nerkach, a zatem rozwój zasadowicy.
Do utraty jonów wodoru przez nerki może dojść także w przypadku tak zwanej tubulopatii. W klasyfikacji medycznej należy ona do rzadkich chorób, które charakteryzują się zaburzeniem funkcji cewek nerkowych. Należą do nich między innymi zespół Barttera oraz zespół Gitelmana.
Alkaloza metaboliczna objawy
Objawy alkalozy metabolicznej są różne i mogą powodować obciążenie poszczególnych układów w różnym stopniu.
Jednym z wyróżników alkalozy metabolicznej są zaburzenia ze strony układu nerwowego. W związku z tym pacjenci mogą cierpieć na: zaburzenia świadomości, zaburzenia pamięci i koncentracji, psychozy, zaburzenia lękowe, zawroty głowy oraz parastezje.
Szczególnym zagrożeniem mogą być symptomy ze strony układu krążenia. Następstwem zaburzeń elektrolitowych mogą być zaburzenia rytmu serca. U chorych następują spadki ciśnienia tętniczego oraz spadek rzutu serca.
Skutkiem zaburzeń ze strony układu oddechowego jest niedobór tlenu we krwi czyli hipoksemia. Może się to wiązać z zaburzeniami pracy mięśni oddechowych.
Do innych objawów alkalozy należą: tężyczka czyli nadmierne skurcze mięśni spowodowane spadkiem poziomu wapnia w surowicy. Do skurczu szkieletowych mięśni kończyn mogą dołączyć tak zwane równoważniki tężyczki, które przybierają formę: skurczu naczyń mózgowych (następstwem tego jest przemijające niedokrwienie mózgu), skurczu naczyń wieńcowych (prowadzi to do objawów choroby niedokrwiennej serca), skurczu naczyń brzusznych (powoduje anginę brzuszną), a także skurczu naczyń obwodowych.
Alkaloza metaboliczna – powikłania i komplikacje
W przypadku nieleczenia możemy spotkać się z różnymi komplikacjami. Odmianę powikłania wyróżniamy na podstawie choroby prowadzącej do alkalozy. W przypadku współwystępowania ciężkich zaburzeń elektrolitowych możemy spotkać się z niebezpiecznymi dla życia zaburzeniami rytmu serca.

Hipowentylacja współistniejąca z zasadowicą metaboliczną może z kolei prowadzić do niedotlenienia ośrodkowego układu nerwowego. W trakcie trwania zasadowicy nieoddechowej pojawiają się działania kompensacyjne, których funkcją jest przywrócenie równowagi kwasowo- zasadowej. Towarzyszą temu procesowi płuca, które dzięki hipowentylacji zwiększają stężenie parcjalne dwutlenku węgla we krwi, oraz nerki, które pozbywają się nadmiaru wodorowęglanów.
Wartość pH krwi decyduje o rokowaniu. Wraz z jego wzrostem rokowanie pogarsza się. Przy wartości pH 7,65 śmiertelność osiąga około 80%.
Alkaloza metaboliczna- badania
Pierwszym badaniem, które wykonuje się w przypadku podejrzenia alkalozy metabolicznej jest gazometria krwi tętniczej. Badanie to polega na pobraniu krwi tętniczej – zazwyczaj z tętnicy udowej lub promieniowej. O alkalozie metabolicznej świadczy podwyższone pH – powyżej 7,45,oraz prawidłowe ciśnienie parcjalne dwutlenku węgla i zwiększony poziom wodorowęglanów. Jest to wówczas zasadowica metaboliczna niewyrównana. Efektem działania mechanizmów kompensacyjnych jest wzrost ciśnienia parcjalnego dwutlenku węgla, a w warunkach zasadowicy całkowicie wyrównanej do unormowania wartości pH.
Alkaloza metaboliczna – leczenie
W leczeniu alkalozy metabolicznej ważna jest walka z przyczynami leżącymi u źródła zachwiania równowagi kwasowo- zasadowej. Nieodzowne może się okazać odstawienie leków moczopędnych lub przeczyszczających. Pacjenci zmagający się z silnymi wymiotami i biegunkami powinni pamiętać o stosownym nawodnieniu- czyli płynoterapii. Kiedy stwierdzony zostaje niedobór potasu konieczne jest jego uzupełnienie.
Natomiast zaleca się aby osoby zdrowe trzymały się zasad prawidłowego żywienia, co może ustrzec je w przyszłości przed zachorowaniem na alkalozę metaboliczną.
źródła zdjęć:
https://szelazo.pl/wp-content/uploads/2018/10/zmęczenieanemia.jpg
https://img-3.fruugo.com/product/4/11/22127114_max.jpg
Zaburzenia owulacji
18 lipca, 2019 BlogCo to jest owulacja?
Owulacja (niefachowo zwana też jajeczkowaniem) jest stanem, w którym pęka dojrzały pęcherzyk jajnikowy i wyzwala z jajnika komórkę jajową (oocyt) do światła jajowodu. Samo jajeczkowanie jest bardzo złożonym procesem, czas jego trwania to 24 godziny i musi dać efekty kobiecy organizm. Zaburzenia owulacji mogą komplikować naturalny proces jajeczkowania.
Jajeczkowanie czyli owulacja
Niektóre kobiety rozpoznają, że mają owulację, gdy towarzyszy im lekki ból jajników. Owulację można też określić za pomocą obserwacji zmian pojawiających się w organizmie – wzrost i spadek temperatury oraz pojawienie się i zmiany śluzu wydzielanego przez szyjkę macicy. Niekiedy stosuje się testy owulacyjne. Co robić jeżeli miesiączka ustaje i występują zaburzenia owulacji?
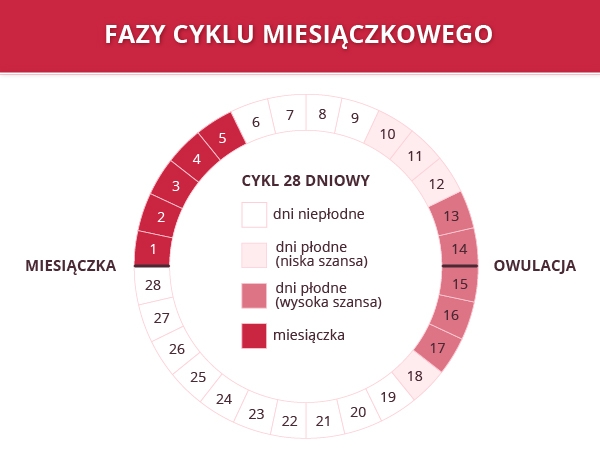
Brak owulacji jest charakterystyczny dla kobiet w młodym wieku i tych starszych może jednak pojawić się u kobiet dojrzałych i w wieku rozrodczym.
Przyczyny braku jajeczkowania
Do przyczyn braku jajeczkowania należą:
– zaburzenia pracy jajników, które nie odpowiadają na sygnały hormonalne
– zaburzenia związane z jedzeniem (otyłość, anoreksja)
– zaburzenia metabolizmu na przykład cukrzyca
– zaburzenia pracy innych gruczołów dokrewnych (na przykład nadnerczy, czy tarczycy)
Lekarz musi zaobserwować jak wygląda stan układu hormonalnego, jego praca. Do jego powinności należy również przyjrzenie się funkcjonowaniu całego organizmu ponieważ konieczne jest wykluczenie przyczyny. Dlatego też, zgłaszając się do lekarza z powodu niemożności zajścia w ciążę, musimy się liczyć z koniecznością wykonania badań pozornie nie związanych z układem rozrodczym.
Symptomy zaburzenia jajeczkowania to nieregularne cykle, które raz wydłużają się w czasie, to znowu trwają krótko, cykle bardzo długie, po których miesiączka jest skąpa. Jeżeli zaobserwujemy nasilenie się dolegliwości napięcia przedmiesiączkowego, to jest to powodem do niepokoju.
Diagnostyka i leczenie zaburzeń jajeczkowania
Aby dokonać rozpoznania najpierw należy wykonać badania podstawowe. Lekarz rozpoczyna ginekologiczne badanie USG, w trakcie trwania którego wydaje opinię, czy nie ma nieprawidłowości w budowie macicy, jajników. Oprócz tego zwykle kieruje na ocenę poziomu hormonów FSH i LH prolaktyny i estradiolu (jeden z estrogenów). Jeżeli wyniki te są bez odchyleń od normy, to kolejnym krokiem jest badanie drożności jajowodów.
Ginekolog za pomocą cewnika założonego do szyjki macicy wprowadza płyn z kontrastem. Przy pomocy USG obserwuje jego przepływ do jajowodów. Dzięki temu badaniu w wypadku niedrożności któregoś z nich będzie to zauważone. Nieodzowne może być też monitorowanie owulacji. Są to badania USG wykonywane ciągiem w trakcie trwania cyklu w odpowiednich dniach. Monitorowanie pozwala na kontrolowanie toku dojrzewania i pękania pęcherzyków lub innych zaburzeń owulacji.

Stymulację hormonalną stosuje się w sytuacji, gdy przyczyną zaburzeń nie są fizyczne nieprawidłowości. Polega ona na wdrożeniu środków, które indukują owulację – wówczas dojrzewa kilka jajeczek, podtrzymywana jest też funkcja ciałka żółtego.
Nie należy lekceważyć faktu, że zaburzenia owulacji (jajeczkowania) to najczęstsza przyczyna niepłodności kobiecej, a dzisiejsza medycyna oferuje szeroki wachlarz możliwości leczenia tego problemu.
źródła zdjęć:
https://dzidziusiowo.pl/img/13118.jpg
https://i.iplsc.com/bol-owulacyjny-nie-musi-byc-sygnalem-choroby-ale-moze-nim-by/00030TZLR6H0IMM7-C122-F4.jpg
Rola glukagonu w organizmie
16 lipca, 2019 BlogCzym jest glukagon?
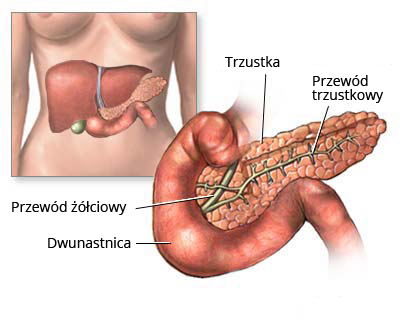
Glukagon należy do hormonów polipeptydowych produkowanych i wydzielanych przez komórki wysp trzustkowych. W przeciwieństwie do insuliny, podwyższa on stężenie cukru we krwi. Można go nazwać hormonem “głodu” ponieważ jego wydzielanie jest zwiększone, gdy mamy dłuższe przerwy między posiłkami, a poziom cukru zaczyna się obniżać do wartości około 70 mg/dl.
Rola glukagonu w organizmie
Glukagon odgrywa ważną rolę w organizmie bo od niego zależą procesy kataboliczne, to znaczy, kiedy on działa organizm czerpie źródło energii z naszych wewnętrznych zapasów, które są magazynowane w wątrobie i tkance tłuszczowej. Dlatego też glukagon możemy nazwać hormonem od spraw spalania tkanki tłuszczowej.
Mechanizm działania glukagonu
Mechanizm działania glukagonu jest bardzo łatwy. Organizm zawsze chce zachować stan równowagi. Gdy stężenie cukru po posiłku jest wyższe, do działania włącza się insulina, która magazynuje glukozę z krwioobiegu w komórkach. Glukagon zaś stanowi przeciwny biegun.
W sytuacji, gdy długo nie spożywamy posiłku, a stężenie cukru we krwi zaczyna spadać, jest to bodziec dla trzustki, aby zaczęła wydzielać glukagon, który trafiając do wątroby zaowocuje przetworzeniem zgromadzonego w niej glikogenu do glukozy. Drugim miejscem, na który wpływ wywiera glukagon jest tkanka tłuszczowa. To właśnie dzięki glukagonowi zaczynamy przekształcać zapasy tłuszczu do glukozy. W ten sposób pozbywamy się niechcianych kilogramów tłuszczu i za jego sprawą utrzymujemy stabilny poziom glukozy we krwi.
Dodatkową pobudką do wytwarzania glukagonu przez trzustkę jest zwiększone stężenie aminokwasów we krwi, które jest następstwem spożycia przez nas produktów będących źródłem białka.
Glukagon i insulina
Glukagon i insulina to zbiór hormonów w naszym organizmie, które działają na prawidłową gospodarkę węglowodanów i tłuszczów. Ich wspólną rolą jest utrzymanie stężenia cukru we krwi w pewnych bezpiecznych wartościach (65 – 100 mg/dl). Wówczas czujemy się dobrze i nie mamy symptomów hiper- lub hipoglikemii.
Problem zaczyna się wtedy, gdy jeden hormon zaczyna górować nad drugim. W dzisiejszej rzeczywistości najbardziej doskwiera nam nadmiar insuliny. W sytuacji, gdy stężenie insuliny utrzymuje się na wysokim poziomie, cały czas jesteśmy nastawieni na “budowanie i gromadzenie zapasów”. Dlatego też powinno się zwrócić uwagę na odpowiednio dobraną dietę, która pomaga w regulacji wydzielania obu hormonów i dojściu do równowagi.
Nadmiar glukagonu i jego skutki
Bardzo rzadko przypuszcza się, że norma glukagonu została przekroczona. Lekarz może zalecić jego oznaczenie w badaniu biochemicznym, gdy istnieje podejrzenie między innymi: cukrzycy, guza trzustki lub dwunastnicy, bądź niewytłumaczalny ubytek masy ciała. Normalnie w warunkach laboratoryjnych glukagon powinien wynosić 50 – 100 ng/l. Kiedy jesteśmy na diecie wysokobiałkowej możemy sprawić, że w organizmie będzie wyższe stężenie tego hormonu, dlatego też mogą być wyższe wyniki we krwi.
Niedobór glukagonu i jego skutki
Niedobór glukagonu jest bardziej powszechny niż jego nadmiar. Możemy powiedzieć, że niedobór ten jest pozorny ponieważ jego powodem jest niewłaściwa dieta (taka, która zawiera łatwo dostępne węglowodany, dużo cukru oraz, gdy często podjadamy). W ten sposób tworzymy spiralę częstych i dużych wyrzutów insuliny.
Jeżeli zastosujemy badania oznaczania insuliny i glukozy na czczo, możemy wstępnie rozpoznać, czy koło napędzania insulinowego może być naszym udziałem. Według statystyk norma insuliny na czczo u zdrowej osoby wynosi ok. 3-6 iIU/m. Niepokojąca dla nas powinna być wartość insuliny na czczo w okolicach 10 – 12 uIU/m. Świadczy to o tym, że organizm wytwarza zbyt duże ilości tego hormonu, a zatem nie ma warunków aby zadziałał w naszym ciele glukagon. Takie osoby często cierpią z tego powodu, że trudno im schudnąć. Czesto można zauważyć u nich proces przybierania na masie ciała, niejako z powietrza.
Glukagon a odchudzanie
Glukagon jest niezwykle ważnym hormonem w odchudzaniu i znacznie ułatwia ten proces. To właśnie za sprawą jego produkcji przez trzustkę pobudzona zostaje tkanka tłuszczowa do zmiany kwasów tłuszczowych na energię. W sytuacji, gdy w organizmie dominuje insulina, glukagon nie może przeforsować swego działania. Osobom, u których zanotowano nadmierny wzrost insuliny zaleca się odpowiednie zestawienie produktów w diecie, w oparciu o te o niskim indeksie glikemicznym, oraz ustalenie pory posiłków.

Najbardziej minimalizuje produkcję glukagonu częste podjadanie. Kiedy robimy sobie przerwę na przekąskę, co dwie godziny, cały czas doprowadzamy do wydzielania insuliny. Wówczas glukagon jest nieprzydatny ponieważ dostarczamy energię z zewnątrz z której otrzymujemy glukozę nie ma więc potrzeby spalania własnych zapasów.
Trzeba pamiętać, że każda przegryzka (każdy orzeszek gryz jabłka, kromka chleba zjedzona w pośpiechu) jest bodźcem do wydzielania insuliny. Nawet kawa z mlekiem, którą pijemy w ciągu dnia łyk po łyczku jest odbierana przez nasz organizm jako przekąska. Dobroczynne może się okazać wydłużenie okresów bez jedzenia do około 3,5- 4 godzin, wówczas może zacząć działać glukagon.
To, co może zaowocować szybszym wydzielaniem glukagonu w okresie poposiłkowym to zawartość białka w spożywanym posiłku. A zatem posiłki, które bazują tylko na węglowodanach są mniej sprzyjające organizmowi.
Oto składniki, które powinny być obecne w diecie: warzywa, w postaci surowej i gotowanej, pełnoziarniste zboża (chleb razowy, gruba kasza na przykład pęczak), produkt będący dobrym źródłem białka (jajka, mięso, rośliny strączkowe, ryby, twaróg, jogurt naturalny), oraz dodatek tłuszczu (oliwa z oliwek, olej rzepakowy, orzechy, niewielki dodatek masła).
Owoce powinny znajdować się w diecie jednak w mniejszych ilościach niż warzywa. Optymalna dawka warzyw do owoców to 4:1. Owoce można z powodzeniem łączyć w posiłku z produktem białkowym (na przykład jogurt) i niewielkim dodatkiem tłuszczu (na przykład orzechy). Efektem tego będzie to, że unikniemy nagłego dużego skoku insuliny i spowodujemy szybsze wydzielanie glukagonu.
źródła zdjęć:
https://apteline-cms.azureedge.net/cdntypo3/_processed1_/e/c/csm_glukagon-model-struktura-molekularna-fotolia-m_e94414c28c.jpg
http://onkologia.org.pl/wp-content/uploads/trzustka.jpg
https://apteline-cms.azureedge.net/cdntypo3/_processed1_/f/a/csm_Monika_Frank_Dietetyk_4_ee9b2dc061.jpg
Testy ciążowe - rodzaje
11 lipca, 2019 BlogTest ciążowy – domowy
Test ciążowy domowy jest dostępny w każdej aptece. Kryterium jest zbadanie probówki moczu. Jeżeli badanie jest wykonane odpowiednio, wiarygodność testu ciążowego domowego, odpowiada badaniom wykonywanym w gabinecie lekarskim lub laboratorium.

Według informacji umieszczonych przez producentów dokładność jest bliska 100%. Gdy w twoim moczu znajduje się hormon hCG (ludzka gonadotropina kosmówkowa), wówczas reaguje pałeczka absorbująca. Należy wyjąć pałeczkę testową z opakowania. Umieścić część absorbującą na kilka sekund w strumieniu moczu. Zaczekać chwilę. O tym, że jesteś w ciąży będzie świadczyło pojawienie się w obu okienkach zabarwienia. Korzyści jakie dają domowe testy ciążowe są takie, że możemy zrobić je prywatnie i mamy możliwość natychmiastowego odczytania wyników.

Do negatywnych stron domowych testów ciążowych zaliczamy to, że mogą dać negatywny wynik, mimo że naprawdę jesteśmy w ciąży. Zalecane jest zatem aby ponowić domowy test ciążowy; ponieważ bardzo ważne jest zadbanie o zdrowie twoje oraz nienarodzonego dziecka od poczęcia.
Test ciążowy – laboratoryjny
Tak jak test domowy również rozpoznaje hormon hCG w moczu z dokładnością około 100% w czasie 7-10 dni od zapłodnienia. W przeciwieństwie do testu domowego wykonywany jest przez fachowca, dlatego można liczyć na to, że został wykonany prawidłowo. Chociaż testy ciążowe z moczu są mniej kosztowne niż testy ciążowe z krwi, to jednak nie są tak często używane ponieważ dostarczają mniej wiadomości. Jeżeli wykonujemy test ciążowy w gabinecie lekarskim, to prawdopodobnie nie będziemy musieli stosować pierwszego porannego moczu, natomiast jeśli chodzi o opcję laboratoryjną , to zachodzi taka potrzeba.

Test ciążowy – test krwi
Materiałem do wykonania tego testu będzie surowica krwi. Test ten odznacza się wielką dokładnością, pozwala na rozpoznanie ciąży już w tydzień po zapłodnieniu ze 100% pewnością. Wykryje również wiek ciąży za pomocą pomiaru zawartości hCG we krwi, która waha się wraz z rozwojem ciąży.Po upływie tygodnia poproś by badanie wykonać jeszcze raz, w celu sprawdzenia czy ciąża rozwija się w prawidłowym tempie i czy wzrasta proporcjonalnie wskaźnik hCG.

źródła zdjęć:
https://www.aptekagemini.pl/poradnik/wp-content/uploads/2018/06/okładka80-695×462.jpg
https://mayorshealthline.files.wordpress.com/2011/06/pregnant-doctor.jpg
https://gfx.zdrowie.radiozet.pl/var/radiozetzdrowie/storage/images/ciaza-i-dziecko/ciaza-i-porod/test-z-krwi-beta-hcg-potwierdzi-lub-wykluczy-ciaze.-kiedy-wykonac-test/305176-1-pol-PL/Test-z-krwi-beta-hCG-potwierdzi-lub-wykluczy-ciaze.-Kiedy-wykonac-test_article.jpg
https://dairyone.com/wp-content/uploads/2018/02/150826_MitchW_0164-e1518550238976-361×450.jpg
Zespół Alagille’a
9 lipca, 2019 BlogCo to jest zespół Alagillea?
Zespół Alagillea to rzadka obejmująca wiele narządów choroba o podłożu genetycznym. Zespół Alagillea to wady wrodzone takie jak: wady układu sercowo- naczyniowego, kręgosłupa i oczu, nerek, a także cholestaza i zmienione rysy twarzy. Statystycznie występuje u 1: 70 000 żywych urodzeń.
Zespół Alagillea – przyczyny i dziedziczenie
U przyczyn zespołu Alagillea leży mutacja genu Jagged 1 (JAG1) umiejscowionego na chromosomie 20 (20p12). Gen JAG1 bierze udział w dostarczaniu sygnału do poszczególnych komórek w trakci rozwoju embrionalnego. Sygnalizacja ta ma wpływ na sposób, w jaki komórki tworzą struktury ciała. Mutacje w genie JAG1 zaburzają ścieżkę sygnałową, co doprowadza do błędów w rozwoju dziecka. Mutację genu JAG1 można obecnie wykryć u 94 procent pacjentów. U innych chorych problem z jego wykryciem nie jest do końca wyjaśniony.
Sposób w jaki dziedziczymy chorobę nazywamy autosomalnym dominującym. Polega to na tym, że osoba dziedziczy jedną prawidłową kopię genu oraz jedną zmienioną kopię genu. Jednakże zmieniona kopia genu dominuje lub staje się ważniejsza od działającej kopii. Następstwem tego są objawy choroby genetycznej.
Zespół Alagillea- objawy
Przewlekła cholestaza (zastój wytwarzanej przez wątrobę żółci) dająca o sobie znać przez takie symptomy jak: uporczywe swędzenie skóry, powiększenie wątroby, zażółcenie powłok skóry, powstawanie żółtaków, czyli grudkowych zmian skórnych, które są spowodowane odkładaniem się cholesterolu- pojawiają się one najczęściej w okolicy powiek. Ten objaw choroby należy do najbardziej stałych. Często pojawia się jako pierwszy symptom zespołu Alagillea w wieku niemowlęcym, ponieważ wówczas nie występują jeszcze inne objawy.
Zespół Alagillea mimo, że występuje rzadko należy do najczęstszych dziedzicznych chorób wątroby.
Typowe dla tej choroby rysy twarzy- głęboko osadzone i szeroko rozstawione oczy, mała szpiczasta broda, wypukłe szerokie czoło.

Wady kości – najczęściej występuje tak zwany krąg motyla, czyli rozszczepienie pojedynczego kręgu, zazwyczaj na wysokości odcinka piersiowego kręgosłupa. Oprócz tego może wystąpić skrócenie bądź brak dystalnych paliczków.
Wady sercowo- naczyniowe– najczęściej jest to obwodowe zwężenie pnia płucnego, czasem towarzyszą temu: zwężenie zastawkowe tętnicy płucnej, tetralogia Fallota oraz inne wady serca. Wówczas mogą wystąpić: sinica, ataki duszności, męczenie się podczas wysiłku.
Wady okulistyczne– najpowszechniej występuje „posterior embryotoxon” – wada, której istotą jest przemieszczenie linii Schwalbego (czyli granicy między rogówką a twardówką) do przedniej komory oka.
Aby rozpoznać zespół Alagillea konieczne jest stwierdzenie pojawienia się trzech z pięciu wymienionych cech lub dwóch u pacjentów z rodzin cierpiących na tą chorobę.
Oprócz tego u chorych mogą być obecne wady nerek (najczęściej kwasica kanalikowa, nerka hypoplastyczna. Rzadziej torbielowatość nerek, mezangiolipidoza, kamica nerkowa), niewydolność zewnątrzwydzielnicza trzustki i niedobór wzrostu (niskorosłość)
Zespół Alagillea – diagnoza

Aby postawić diagnozę zespółu Alagillea, trzeba wziąć pod uwagę, że jest to złożona jednostka chorobowa, należy więc, wykonać szereg badań takich jak, między innymi: echokardiografię serca, badani krwi, badania radiologiczne klatki piersiowej, badanie przedniego odcinka gałki ocznej przy użyciu lampy szczelinowej, a czasami także badanie histopatologiczne wycinka wątroby.
Zespół Alagillea – leczenie
W zakres terapii zespołu Alagillea wchodzą:
– leczenie niedożywienia, wodobrzusza, zaburzeń krzepnięcia, wstępujących zapaleń dróg żółciowych i krwawień z żylaków przełyku.
– podawanie choremu witamin rozpuszczalnych w tłuszczach i kwasu ursodezoksycholowego (rozpuszcza cholesterolowe zmiany żółciowe), a gdy świąd jest intensywny- ryfampicyny
– zabieg częściowego zewnętrznego odprowadzenia żółci
W niektórych przypadkach konieczny jest przeszczep wątroby.
Zespół Alagillea – rokowania
Rokowania uzależnione są od obecności i nasilenia choroby wątroby i układu sercowo- naczyniowego. Jak stwierdzono w badaniach, część pacjentów może nie przeżyć z powodu niewydolności wątroby, czy przez problemy sercowe oraz wylew krwi do mózgu.
źródła zdjęć:
https://ocdn.eu/images/pulscms/YWY7MDA_/2d7d138859fc5122144d0dfd5bc616e2.jpg
https://www.imma-polska.pl/wp-content/uploads/2016/03/Fotolia_103105493_S,jpg
Choroba HALLERVORDENA
4 lipca, 2019 BlogNa czym polega choroba Hallervordena?
Choroba Hallervordena jest to zwyrodnienie układu nerwowego z namnożeniem się żelaza w mózgu. Jest rzadką, dziedziczną chorobą, której istotą jest neurologiczne, postępujące zaburzenie ruchowe. Ostatnio udało się znaleźć jedną z genetycznych przyczyn choroby, jednakże są jeszcze inne geny wywołujące tę chorobę, które nie zostały zidentyfikowane. U około 50% pacjentów zaobserwowano mutację genu PNAK 2, który bierze udział w metabolizowaniu witaminy B5. Cechą charakteryzującą wszystkie przypadki choroby jest gromadzenie się żelaza w mózgu wraz z postępującymi zaburzeniami ruchu. Pacjenci mogą przez dłuższe etapy czasu czuć się dobrze (sytuacja chorego może być ustabilizowana), po czym następuje remisja objawów. Oczywiście nie ma takich samych przypadków choroby, każdy jest indywidualny. Dzieje się tak dlatego, że genetyczne mutacje mogą się różnić w poszczególnych rodzinach.

Czynniki wpływające na intensyfikację symptomów choroby i na jej bardziej dynamiczny rozwój nie zostały poznane. Cechy wyróżniające tę chorobę i występujące u wszystkich pacjentów to: dystonia (anomalia w napięciu mięśniowym, torsje), sztywność mięśni i nagłe mimowolne skurcze mięśni (spastyczność). Wyróżnione cechy mogą stać się przyczyną problemów z chodzeniem, niezdarności, trudności w kontrolowaniu ruchów i problemów z mówieniem. Inną cechą łączącą te przypadki jest degeneracja siatkówki, która prowadzi do postępującej kurzej ślepoty. Niestety trzeba przygotować się na to, że objawy choroby postępują i są coraz silniejsze. Choroba różni się pod względem problemów jakie wywołuje. Ważne jest edukowanie rodziców dzieci,u których dopiero co zdiagnozowano tę chorobę, aby zdawali sobie sprawę z owej różnorodności objawów, którymi przejawia się to schorzenie. Istnienie wielu objawów nie jest równoznaczne z tym, że u każdego dziecka będą obecne wszystkie z nich lub, że będą one bardzo nasilone.
Jakie są objawy choroby Hallervordena?
Nerwowo- mięśniowe objawy powiązane z wszystkimi formami choroby Hallervordena:
– Choreoatetoza – jest położeniem, w którym pojawiają się mimowolne nagłe i nerwowe ruchy (pląsawica) występujące na przemian z stosunkowo wolnymi, wykręcającymi ciało ruchami (atetoza).
– Dystonia jest zaliczana do grupy zaburzeń mięśni gładkich, wywołujących ich kurczenie się, które mogą zmuszać pewne części ciała do niezwykłych i bolesnych ruchów oraz pozycji. Dystonia (mimowolne skurcze mięśni) oddziałuje również na mięśnie w ustach i gardle, co może być przyczyną słabej artykulacji i mamrotania (dysarthria), a także trudności z połykaniem. Postępująca dystonia w tych mięśniach, powoduje możliwą utratę mowy, jak również gryzienie języka.
– Blepharospasm – jest to upośledzenie mięśni powiek, którego konsekwencjami są nadmierne mruganie i mimowolne zamknięcie powiek.
– Spastyczność i sztywność mięśniowa – początkowo dotyka nóg. W późniejszym stadium rozwija się w ramionach, co wywołuje utratę kontroli nad ruchami ciała. Skurcze mięśni mogą powodować złamania kości (które nie są skutkiem traumy ani wypadku)
– Torticollis – bezwiedne kurczenia się z mięśni szyi, powodujące odbiegające od normy ruchy i pozycje głowy i szyi.
Jakie są rokowania w przypadku tej choroby?
Choroba Hallervordena jest postępowym niedowładem. Ma charakter nagłych wybuchów choroby, nie posuwa się do przodu w równym tempie. Okresy nagłego pogorszenia trwające przez odcinek czasu od jednego do dwóch miesięcy, przeplatają się ze stanami stabilizacji pomiędzy. Zaczynając się u dzieci choroba może rozwijać się szybciej. Chorzy nie mogą poruszać się o własnych siłach i potrzebują wózka inwalidzkiego, z uwagi na fakt rozwijającej się u nich dystonii i spastyczności. Przedwczesna śmierć jest możliwa w chorobie Hallervordena. Jednak długość życia pacjentów nie jest stała. Chorzy, którzy są pod stałą opieką lekarską mogą dożyć nawet do wieku dojrzałego. Powodem przedwczesnej śmierci jest zazwyczaj dystonia i ograniczone przełykanie, które może powodować zmniejszoną rację spożywanych posiłków i zapalenie płuc. Lepsze rokowania mają pacjenci, u których choroba pojawiła się w późniejszym wieku, choroba przebiega łagodniej, a co za tym idzie mogą oni dożyć do wieku dojrzałego.
Jak można rozpoznać chorobę?
Aby zdiagnozować chorobę Hallervordena należy wykonać badanie rezonansu magnetycznego. Jest to metoda obrazowa, która daje obszar do obserwacji charakterystycznego nagromadzenia się żelaza w pewnych obszarach mózgu (istota szara).
Choroba Hallervordena – leczenie
Nie ma uniwersalnego sposobu leczena tej choroby, polega ono głównie na łagodzeniu jej objawów. Leczenie może obejmować współpracę specjalistów takich jak: pediatra albo internista, neurolog, okulista i genetyk. Zespołowe wsparcie terapeutyczne powinno obejmować także: gimnastykę, fizjoterapię, hipnoterapię oraz masaże rozluźniające mięśnie.
źródła zdjęć:
https://s3.envato.com/files/244482792/preview.jpg
https://cdn.galleries.smcloud.net/t/galleries/gf-cDg9-YsRq-Lq8V_choroba-hallervordena-spatza-to-zwyrodnienie-ukladu-nerwowego-1920×1080-nocrop.jpg
Glejak mózgu
2 lipca, 2019 BlogCo to jest glejak mózgu?
Glejaki w terminologii medycznej należą do grupy nowotworów ośrodkowego układu nerwowego, które mają swój początek w komórkach glejowych. Glejaki mają różne postacie w obrębie komórek mózgu, w których mają swoje źródło (astrocyty, oligodentrocyty). Różnią się także stopniem agresywności.
Nowotwory złośliwe czyli glejaki, które mogą występować w każdym miejscu w obszarze ośrodkowego układu nerwowego, co wskazuje głównie na mózg, a rzadziej na rdzeń kręgowy. Glejaki wyróżniają się właściwością polegającą na lokalnym rozszerzaniu się w obrębie ośrodkowego układu nerwowego.
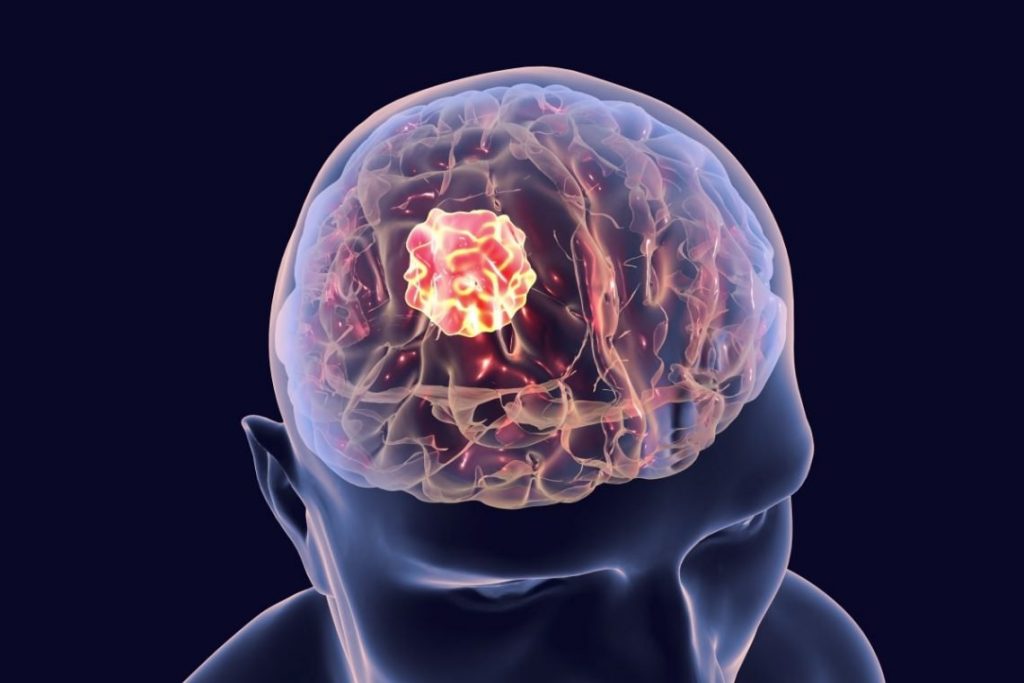
Nowotwory tego typu mogą pojawiać się u osób w każdym wieku, jednak najbardziej rozpowszechnione są u osób w 5. i 6. dekadzie życia.
Przyczyny glejaka
Nie znane jest pochodzenie tej choroby. Znaleziono co prawda kilka czynników ryzyka, które mogą zwiększać prawdopodobieństwo zachorowania na glejaka, choć nie zawsze okazują się one czynnikiem sprawczym. Czynniki ryzyka mogą mieć wpływ na zachorowanie, ale nigdy nie stanowią bezpośredniej przyczyny choroby.
Wśród czynników, które mogą zwiększyć ryzyko zachorowania można wymienić:
– tendencje rodzinne: występowanie glejaka wśród najbliższych krewnych (przynajmniej jeden przypadek w tej samej rodzinie) dwukrotnie zwiększa niebezpieczeństwo zachorowania
– zespoły genetyczne: niektóre wrodzone zespoły predestynują do większego niebezpieczeństwa zachorowania na glejaka głównie z powodu obecności jednej lub więcej mutacji genetycznych. Przykładowo są to zespoły: Cowden, Turcota, Lyncha, Li–Fraumeniego oraz
nerwiakowłókniakowatość typu I.
Rodzaje glejaków
Glejaki, po poddaniu badaniom histopatologicznym wyróżnia się ze względu na typy komórek nerwowych, z których się wywodzą (astrocyty, oligodendrocyty lub ependymocyty).
Istnieje również podział w skali od I do IV. W rozróżnieniu tym bierzemy pod uwagę szybkość wzrostu guza i jego agresywność.
– guzy I stopnia – występują one również u dzieci, dają najlepsze rokowania
– guzy II stopnia – (glejaki wysokozróżnicowane) należą do guzów wolno rosnących, naciekowych, wiążą się ze średnimi rokowaniami
– guzy III stopnia (anaplastyczne) i IV stopnia (glejaki wielopostaciowe) są agresywne o najmniej korzystnym rokowaniu.
Objawy glejaka
Może zaistnieć przypuszczenie o glejaku, gdy pojawiają się niepokojące objawy takie jak: zawroty głowy, zachwiania równowagi, napady padaczkowe, zmiany osobowości oraz wszelkiego rodzaju zaburzenia neurologiczne- w tym zaburzenia widzenia, mówienia, utrata siły mięśniowej, zmiana chodu. Objawy glejaka mogą również dawać o sobie znać pod postacią wzrostu ciśnienia w czaszce. Symptomami tego mogą być: bóle głowy, mdłości, senność, wymioty.
Glejak diagnoza
Przy rozpoznaniu glejaka lekarz kieruje na badanie rezonansu magnetycznego (MRI) mózgu. Zakres obrazowy tej metody pozwala nie tylko na wykrycie glejaka, ale także na określenie obszaru choroby.
W razie podejrzenia guza mózgu często najpierw stosuje się tomografię komputerową z użyciem środka kontrastowego.
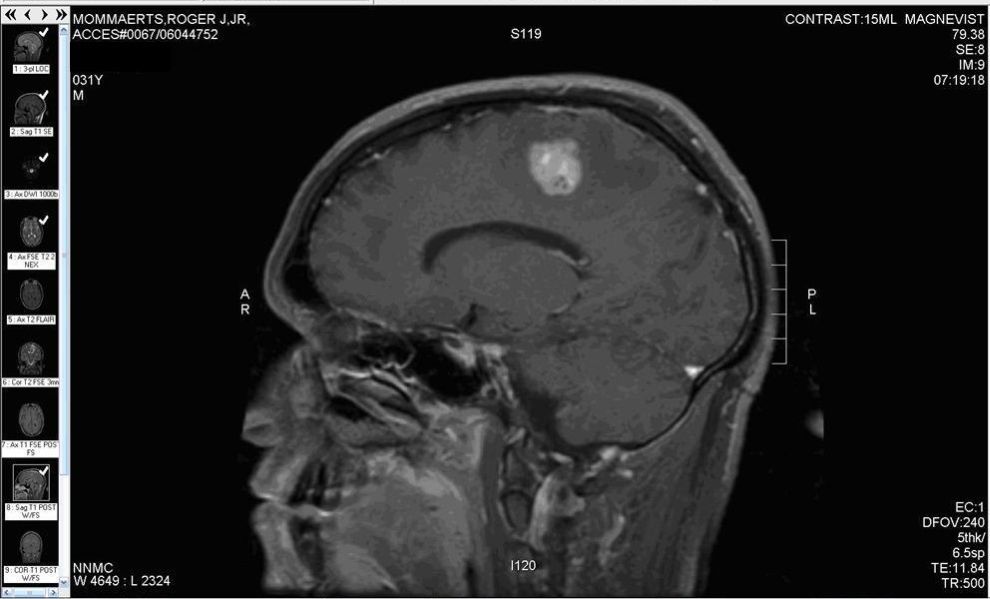
Należy również pobrać tkankę do badania histopatologicznego- podczas operacji chirurgicznej lub za pomocą biopsji. Badanie laboratoryjne tkanki ma za zadanie uprawomocnienie rozpoznania i określenie charakterystyki, podtypu guza, co stanowi podpowiedź co do sposobu leczenia.
Glejak leczenie
Podstawowym leczeniem glejaka jest zabieg chirurgiczny o możliwie jak najszerszym zakresie. Leczenie podjęte po operacji zależy od podtypu glejaka:

– glejak wysokozróżnicowany (stopień 1 i 2) u osób, u których możliwe jest w dużym stopniu ryzyko nawrotu choroby po operacji wdraża się radioterapię. Mniejsze znaczenie ma w leczeniu glejaków wysokozróżnicowanych chemioterapia stosuje się ją wówczas, gdy guz nie ma zalecenia do operacji, lub w przypadku guzów nawracających po radioterapii.
– glejak anaplastyczny (stopień 3) pooperacyjne leczenie glejaka anaplastycznego polega na zastisowaniu radioterapii a następnie chemioterapii.
– glejak wielopostaciowy (stopień 4) leczenie po opercji wymaga jednoczesnego stosowania chemioterapii i radioterapii (leczenie skojarzone)
źrodła zdjęć:
https://www.hellozdrowie.pl/wp-content/uploads/2019/01/glejak-wielopostaciowy-1140×760.jpg
https://glejak.com/wp-content/uploads/2013/10/glejak-mozgu-rak-mozgu.jpg
https://i.wpimg.pl/640×284/portal-abczdrowie.wpcdn.pl/imageCache/2018/11/22/98189108-m_c1e9.jpg

